Plan de chapitre
ITEM 312 – Tumeurs du sein
I. Généralités
– A. Prévalence et épidémiologie
– B. Facteurs de risque
– C. Prédispositions génétiques
II. Stratégie d’exploration en imagerie
– A. Diagnostic
– B. Bilan d’extension
– C. Suivi post-thérapeutique
III. Sémiologie
– A. En mammographie
– B. En échographie
– C. En IRM
– D. En angiomammographie
– E. En TEP-TDM au 18FDG
Situations de départ
- 16 Adénopathies unique ou multiples.
- 181 Tumeurs malignes sur pièce opératoire/biopsie.
Item, hiérarchisation des connaissances
| Rang | Rubrique | Intitulé | Descriptif |
| Prévalence, épidémiologie | Connaître l’épidémiologie des tumeurs du sein* | Connaître l’incidence et la prévalence des cancers du sein en France | |
| Prévalence, épidémiologie | Connaître les facteurs de risque des tumeurs du sein* | Énumérer les principaux facteurs de risque intrinsèques et extrinsèques du cancer du sein | |
| Éléments physiopathologiques | Connaître les prédispositions génétiques du cancer du sein* | Connaître les prédispositions génétiques associées à un surrisque de cancer du sein : mutations BRCA1/2, syndrome sein-ovaire, rôle de BRCA1/2 dans l’oncogenèse | |
| Éléments physiopathologiques | Connaître l’histoire naturelle du cancer du sein et ses modes de dissémination* | Expliquer l’histoire naturelle du cancer (cancérogenèse) du sein et ses modes de dissémination | |
| Diagnostic positif | Connaître les différentes modalités de dépistage* | Palpation, mammographie… | |
| Diagnostic positif | Connaître les présentations cliniques des tumeurs du sein* | Signes cliniques mammaires : nodule, écoulement, inflammation, lésions cutanées | |
| Contenu multimédia | Clichés photographiques des lésions, anomalies cutanées, sein* | Écoulements sanglants/lactescents, méplat, sein inflammatoire | |
| Examen complémentaire | Connaître les indications de la mammographie | Indication et non-indication | |
| Examen complémentaire | Connaître les indications de la biopsie mammaire | Indication et non-indication | |
| Définition | Connaître les principaux types de lésions bénignes et de tumeurs malignes du sein* | Mastopathie fibrokystique, adénofibrome, carcinome infiltrant de type non spécifique, carcinome lobulaire infiltrant | |
| Examens complémentaires | Connaître les principes du bilan d’extension d’un cancer du sein | ||
| Prise en charge | Objectifs et principes de traitement du cancer du sein* | ||
A. Prévalence et épidémiologie

Le cancer du sein est le deuxième cancer le plus fréquent en France chez la femme, la première cause de décès par cancer ; il est au troisième rang des décès toutes causes. Les cancers du sein sont les cancers les plus fréquents de la femme : 10 % des femmes en seront atteintes.
Ainsi, en France :
- 10 millions de femmes ont été invitées au DO (dépistage organisé) (campagne de 2017 et 2018) ;
- 2,6 millions de femmes ont fait leur mammographie dans le cadre du DO (2018) ;
- 58 968 femmes ont eu un diagnostic de cancer du sein (2018).
B. Facteurs de risque
Les principaux facteurs de risque de cancer du sein sont les suivants :
- l’âge (78 % des cancers sont diagnostiqués chez des femmes âgées de plus de 50 ans) et le sexe (moins de 1 % de tous les cancers du sein sont observés chez l’homme) ;
- une prédisposition génétique (5 % à 10 % des cancers du sein sont d’origine génétique ; cette prédisposition est liée, le plus souvent, à l’altération génétique des gènes BRCA1 ou BRCA2) ;
- un antécédent personnel de cancer du sein invasif, carcinome canalaire in situ ou de lésions histologiques à risque (hyperplasie lobulaire atypique ou cancer lobulaire in situ) ;
- un antécédent personnel d’irradiation thoracique médicale à haute dose (dont antécédent d’irradiation pour maladie de Hodgkin).
C. Prédispositions génétiques
Ils se développent à partir des unités terminales ductolobulaires et sont dans la majorité des cas de type canalaire ou lobulaire. Le carcinome canalaire infiltrant est la forme la plus fréquente des cancers du sein avec des cellules malignes de type canalaire qui ont franchi la membrane basale pour infiltrer le tissu conjonctif.
Les cancers du sein liés à une mutation génétique comptent pour 5 % à 10 % des cancers du sein. On estime qu’environ 2 femmes sur 1 000 sont porteuses d’une mutation de BRCA1 ou de BRCA2 (gène localisé sur le chromosome 17 pour BRCA1 et le chromosome 13 pour BRCA2, transmission autosomique dominante). Être porteur d’une mutation sur un de ces gènes augmente le risque d’avoir un cancer du sein avant la ménopause (40 % à 85 %). Néanmoins, toutes les femmes porteuses de ces mutations génétiques ne développeront pas un cancer du sein. Chez une femme porteuse de la mutation BRCA1 ou BRCA2, le risque de cancer du sein controlatéral est également augmenté, ainsi que le risque de cancer de l’ovaire.
D’autres mutations génétiques, plus rares, augmentent également le risque de cancer du sein. Les femmes porteuses d’une mutation génétique prédisposant au cancer du sein doivent bénéficier d’une stratégie de prise en charge spécifique, dans le cadre d’une consultation d’oncogénétique, fondée sur la surveillance et/ou la chirurgie prophylactique.
II. Stratégie d’exploration en imagerie
L’imagerie participe au diagnostic, fait le bilan d’extension et est partie prenante de la surveillance post-thérapeutique.
A. Diagnostic
Le diagnostic de lésion tumorale repose sur l’imagerie, toujours précédée d’un examen clinique et d’un interrogatoire soigneux. L’imagerie peut :
- soit être motivée par un examen clinique évocateur ;
- soit entrer dans le cadre du dépistage organisé (entre 50 et 74 ans) ou individuel (en dehors de cette tranche d’âge) ;
- soit entrer dans le cadre du dépistage individuel.
L’imagerie comporte la mammographie ± l’échographie (en cas de seins denses ou chez les femmes jeunes).
Le diagnostic positif définitif est histologique, sur prélèvement biopsique en règle guidé par l’imagerie.
1. Mammographie
C’est l’examen de dépistage proposé gratuitement à toutes les femmes de 50 à 74 ans tous les deux ans. Elle doit être bilatérale et comparative (sein à sein et avec les examens antérieurs), deux incidences pour chaque sein (face et oblique externe).
Elle utilise la classification BI-RADS (Breast Imaging-Reporting And Data System) de l’American College of Radiology (ACR) en sept catégories pour préciser le degré de suspicion de malignité :
- BI-RADS ACR0 : évaluation incomplète ; des investigations complémentaires sont nécessaires ;
- BI-RADS ACR1 : mammographie normale ;
- BI-RADS ACR2 : résultat typiquement bénin ;
- BI-RADS ACR3 : anomalie probablement bénigne nécessitant une surveillance à 6 mois ;
- BI-RADS ACR4 : anomalie suspecte nécessitant une vérification histologique ;
- BI-RADS ACR5 : cancer hautement probable, risque supérieur à 95 % ;
- BI-RADS ACR6 : malignité prouvée (résultat de biopsie connu).
Les mammographies dites ACR1 et ACR2 seront relues par un second lecteur.
2. Échographie mammaire

C’est l’examen de deuxième intention pour aider à caractériser une lésion vue en mammographie chez les femmes de plus de 40 ans, en cas de seins denses ou en cas d’anomalie clinique sans traduction mammographique. C’est aussi un examen de première intention chez la femme jeune (moins de 40 ans).
Elle peut aider à guider des prélèvements biopsiques.
3. Biopsie mammaire guidée par imagerie
La preuve histologique du cancer du sein est nécessaire. Selon la présentation clinique et radiologique, une microbiopsie sous guidage échographique, une macrobiopsie sous guidage stéréotaxique ou une biopsie sous guidage IRM seront réalisés.
4. IRM
C’est un examen réservé à des situations particulières, dont le dépistage chez des patientes à haut risque présentant une mutation BRCA1 ou BRCA2.
B. Bilan d’extension
L’échographie complète la mammographie à la recherche de lésions surnuméraires dans des seins denses et est systématique dans le bilan d’extension pour explorer les aires ganglionnaires (axillaire, sus- et sous-claviculaires, chaîne thoracique interne) et guider les prélèvements.
L’IRM recherche des lésions multiples — si un traitement chirurgical conservateur est envisagé —, mais il n’y a pas d’indication à sa réalisation systématique.
La prescription d’une IRM ne doit pas retarder la prise en charge thérapeutique.
Ses indications potentielles sont :
- une histologie lobulaire ;
- une discordance entre la clinique et l’imagerie standard pouvant entraîner une modification de la prise en charge thérapeutique ;
- avant mise en place d’une chimiothérapie néoadjuvante et son suivi ;
- chez des femmes de moins de 40 ans ;
- chez les femmes à haut risque familial de cancer du sein ;
- dans les cas plus susceptibles de développer une multifocalité/multicentricité ;
- en cas de choix thérapeutique difficile.
L’angiomammographie est une technique combinant la mammographie numérique standard à une injection de produit de contraste iodé afin d’améliorer la détection des lésions. Les indications retenues par la HAS en 2021 pour l’évaluation de l’angiomammographie sont les suivantes :
- bilan diagnostique, notamment dans les situations d’impasses diagnostiques.
- bilan d’extension locorégional préopératoire.
- avant une chimiothérapie néoadjuvante ainsi que dans l’évaluation de la réponse à la chimiothérapie néoadjuvante.
- recherche de récidive après traitement conservateur d’un cancer du sein et en cas d’image douteuse non complètement évaluée après bilan mammographique et échographique.
La TDM thoraco-abdomino-pelvienne est indiquée dans le bilan initial des cancers à risque élevé de métastases en association avec une scintigraphie osseuse (figure 34.1), ou une TEP-TDM au 18FNa si la technique est disponible.
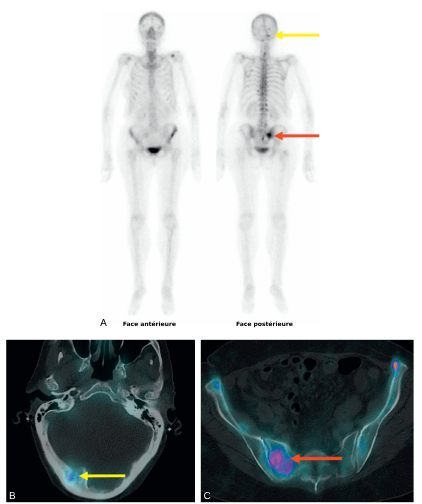

Fig. 34.1 Bilan d’extension par scintigraphie osseuse « corps entier » (A) et couplée à la TDM (B, C) d’un cancer du sein, mettant en évidence des lésions osseuses mixtes, à prédominance ostéolytique, hyperfixantes, notamment de la base du crâne (flèches jaunes) et de l’aileron sacré droit (flèches rouge).
Source : CERF, CNEBMN, 2022.
La TEP-TDM au 18FDG est recommandée dans le bilan initial des cancers du sein à partir du stade IIB (figure 34.2).
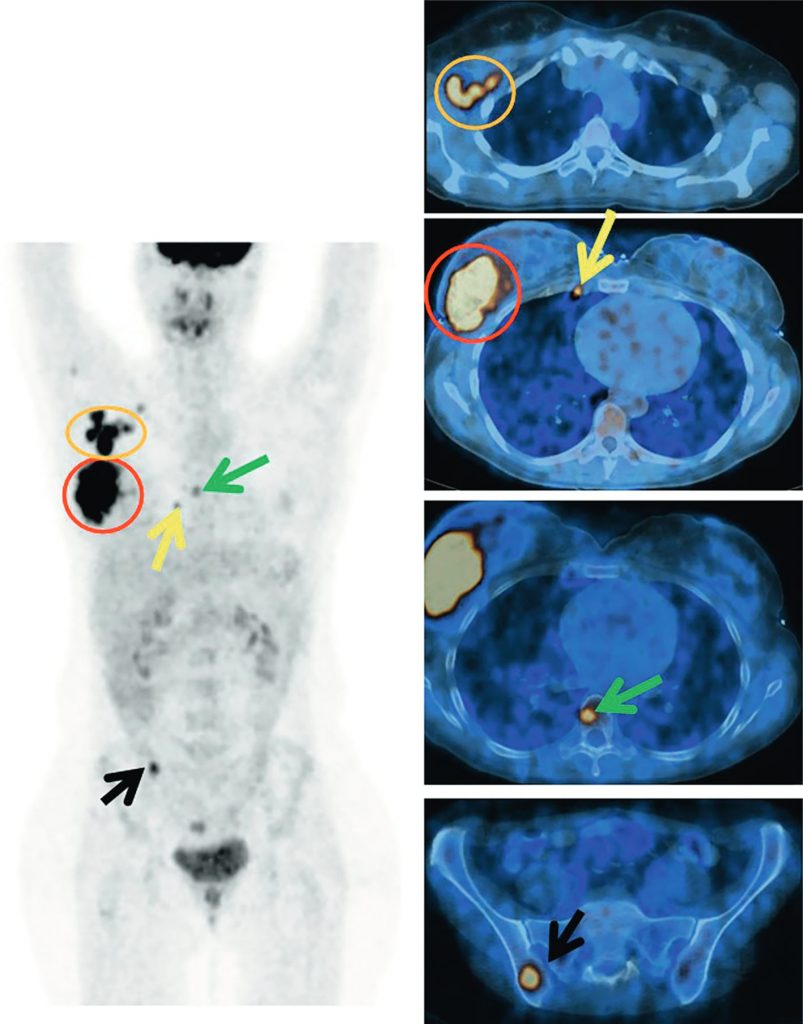

Fig. 34.2 Bilan d’extension par TEP-TDM au 18FDG d’un cancer du sein localement avancé.
Lésion mammaire (cernée en rouge) associée à une atteinte axillaire homolatérale (cernée en orange). Découverte d’une atteinte lymphatique mammaire interne droite (flèche jaune) ainsi que d’une atteinte osseuse : corps vertébral de T8 (flèche verte) et ischion droit (flèche noire).
Source : CERF, CNEBMN, 2022.

Elle peut être proposée pour évaluer la réponse au traitement néoadjuvant (figure 34.3).
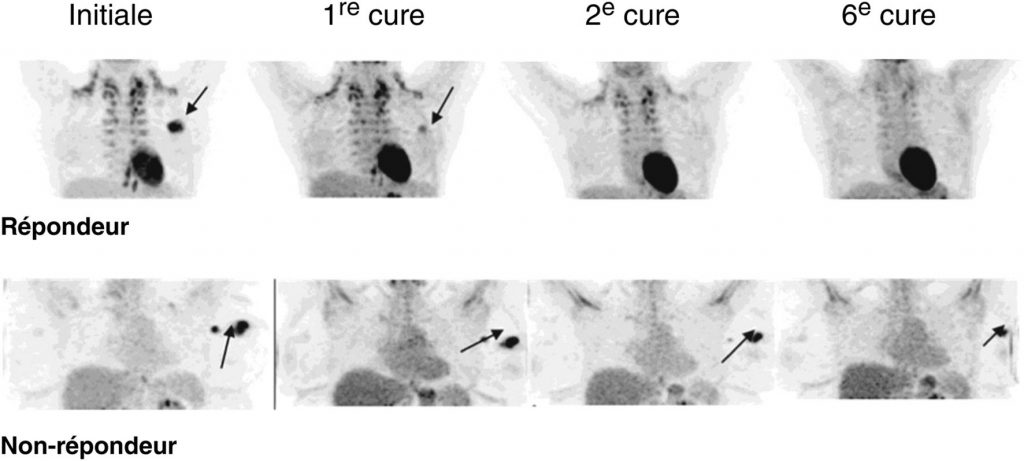

Fig. 34.3 Évaluation thérapeutique par TEP au 18FDG dans le cadre d’un cancer du sein localement avancé traité par chimiothérapie néoadjuvante.
Pour la patiente « répondeur » (en haut) : disparition de la lésion mammaire initiale. Pour la patiente « non-répondeur » (en bas) : disparition de l’atteinte axillaire homolatérale mais persistance de la lésion mammaire.
Source : CERF, CNEBMN, 2022.

La lymphoscintigraphie aux colloïdes technétiés en préopératoire, pour la recherche de nœuds lymphatiques (« ganglions sentinelles »), est indiquée en routine pour les cancers du sein T1N0, T2N0 inférieur à 3 cm (jusqu’à moins de 5 cm après avis de la réunion de concertation pluridisciplinaire) si N0 clinique et/ou échographique et cytologie négative (stades I-IIA) (figure 34.4).
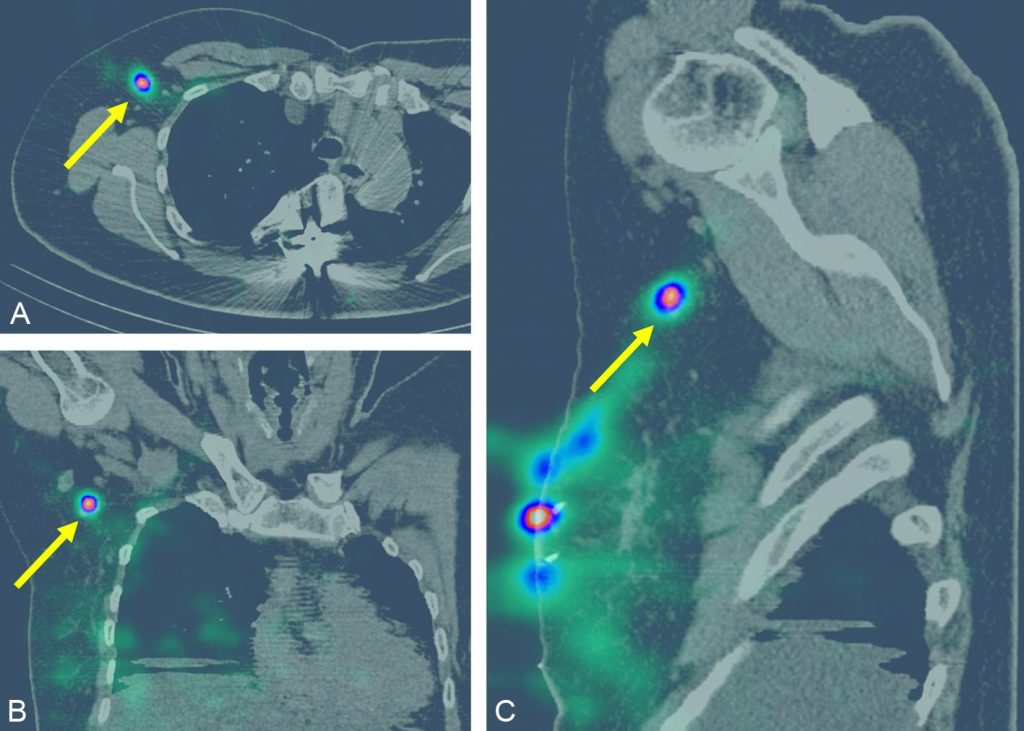

Fig. 34.4 Scintigraphie du ganglion sentinelle couplée à la TDM d’un cancer du quadrant supéro-externe du sein droit mettant en évidence un relais ganglionnaire hyperfixant en axillaire droit (flèches jaunes) sur les coupes transversales (A), coronales (B) et sagittales (C).
Source : CERF, CNEBMN, 2022.
C. Suivi post-thérapeutique

La mammographie est préconisée en premier bilan, entre 6 mois et 1 an après la fin du traitement locorégional (radiothérapie) et classiquement tous les ans sans limitation d’âge. L’examen doit être bilatéral (si traitement conservateur) ou unilatéral (si mastectomie).
L’échographie peut compléter la mammographie si nécessaire et pour évaluer une prothèse mammaire et analyser les cicatrices.
L’IRM n’a pas d’indication sans signe d’appel (suspicion de récidive locale en imagerie standard ou signes cliniques suspects avec bilan d’imagerie standard normal).
La scintigraphie osseuse est indiquée en cas de douleurs osseuses.
La TEP-TDM au 18FDG est recommandée en cas de récidive prouvée ou suspectée (figures 34.5 et 34.6).
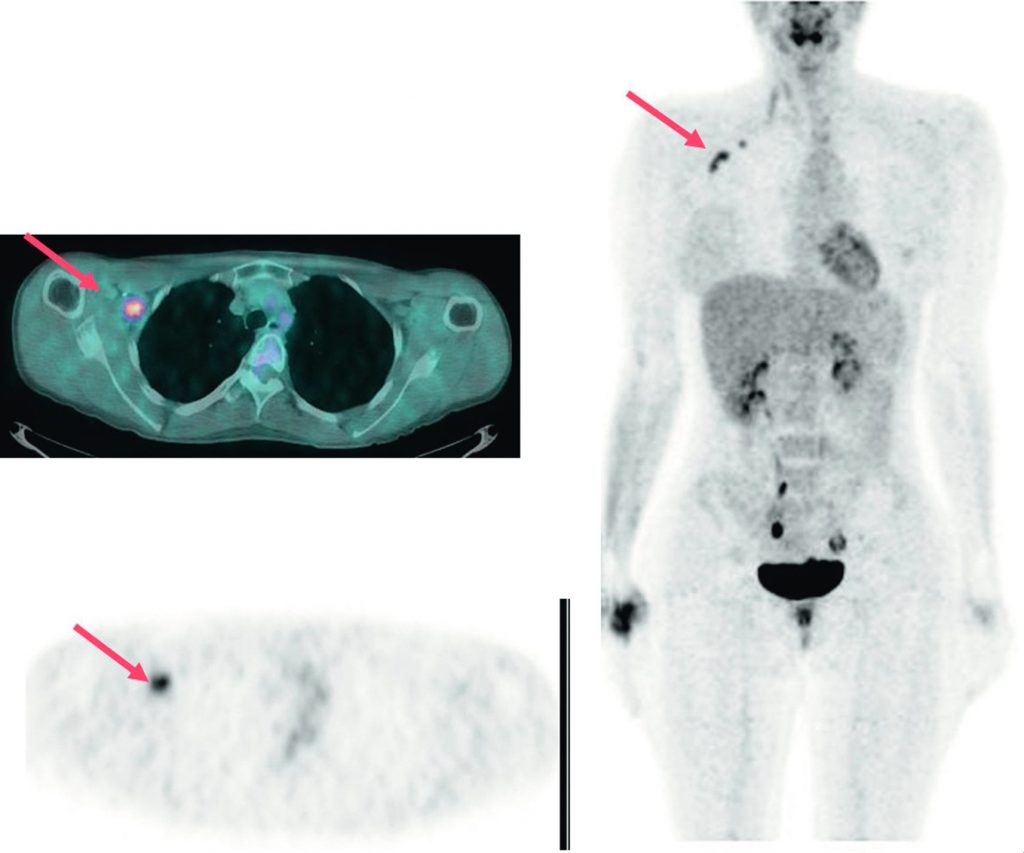

Fig. 34.5 Dans le suivi d’une patiente pour cancer du sein droit, apparition d’une élévation du CA15-3 avec bilan morphologique négatif.
La TEP-TDM au 18FDG met en évidence une récidive axillaire droite bifocale isolée (flèche).
Source : CERF, CNEBMN, 2022.
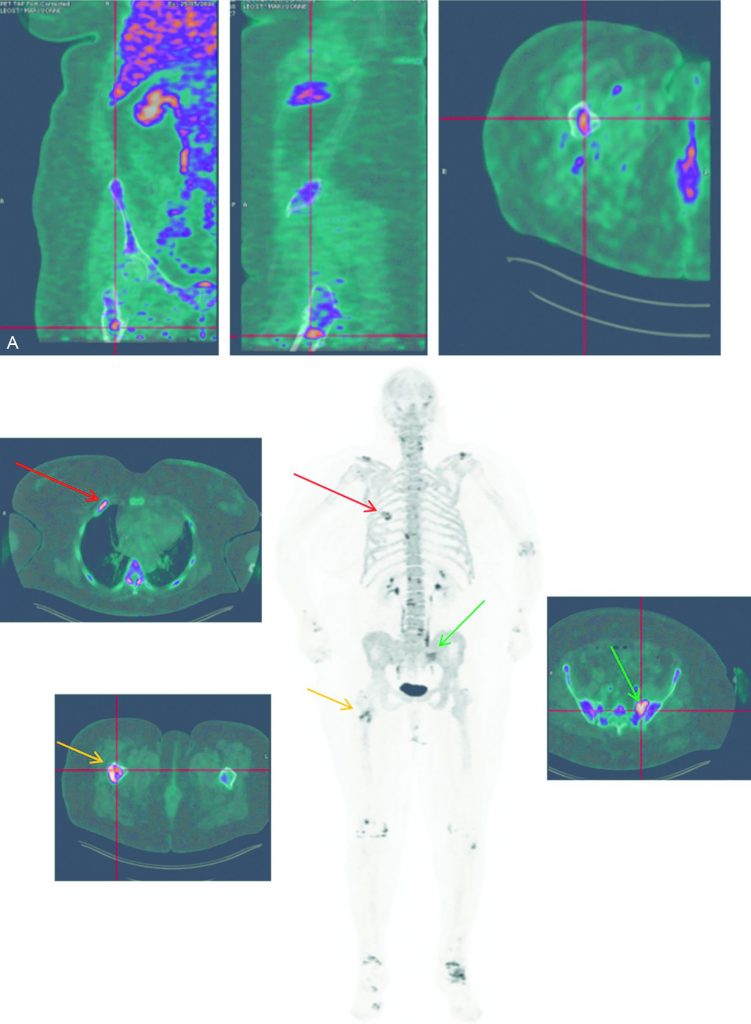

Fig. 34.6 TEP-TDM au 18FNa pour une patiente suspecte de récidive de cancer du sein.
A. Petite lésion osseuse fémorale droite isolée. B. Mise en évidence de localisations secondaires osseuses costale droite (flèche rouge), du sacrum latéralisé à gauche (flèche verte) et de la diaphyse fémorale droite (flèche orange). À noter une atteinte arthrosique diffuse (rachis, acromion, genoux et chevilles).
Source : CERF, CNEBMN, 2022.
III. Sémiologie
A. En mammographie
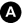
Les images évocatrices de malignité sont (figures 34.7 et 34.8) :
- les masses spiculées à centre dense et les masses mal circonscrites à contours flous ;
- les foyers de microcalcifications nombreuses, irrégulières ou vermiculaires de topographie canalaire ou segmentaire (suivant l’arbre galactophorique) ;
- les distorsions architecturales ;
- les asymétries de densité.
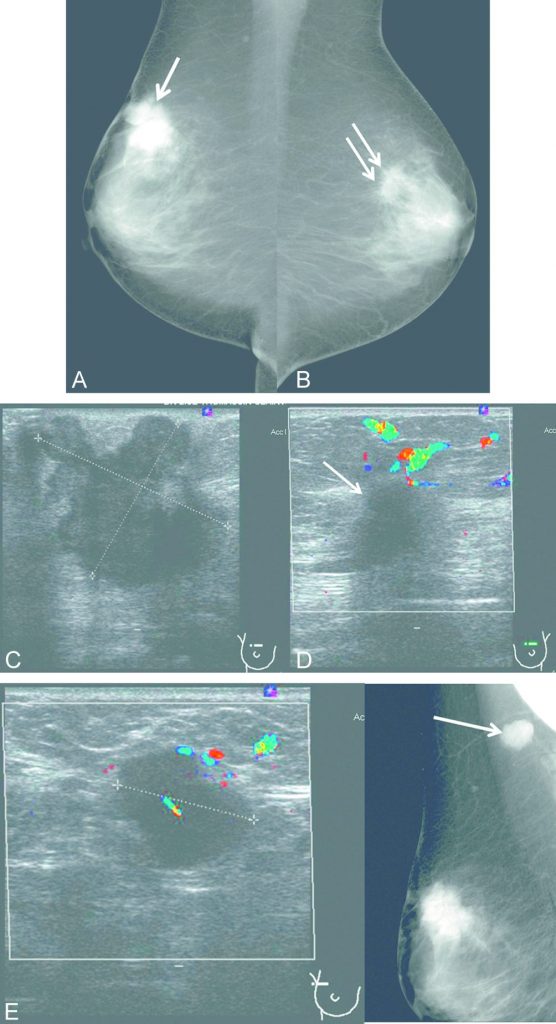
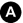
Fig. 34.7 Mammographie bilatérale chez une patiente âgée de 76 ans présentant un nodule palpable du sein droit. À gauche, il n’existe aucune anomalie à l’examen clinique. Antécédents familiaux de cancer du sein chez une sœur âgée de 68 ans.
Clichés axillaires droit (A) et gauche (B) : masse de contours spiculés du quadrant supéro-externe du sein droit (flèche) avec rétraction cutanée et masse spiculée de l’union des quadrants supérieurs du sein gauche (double flèche). Échographie des deux seins : nodules hypoéchogènes de grand axe vertical droit (C) et gauche (D) présentant des contours irréguliers faisant classer ces lésions ACR5 bilatérales. Échographie axillaire bilatérale pour le bilan locorégional : adénopathie axillaire suspecte (perte du hile hyperéchogène, forme ronde, présence d’un flux cortical en mode doppler) (E). Ce nœud lymphatique est également visible sur un cliché mammographique axillaire spécifique à droite (flèche).
Source : CERF, CNEBMN, 2022.
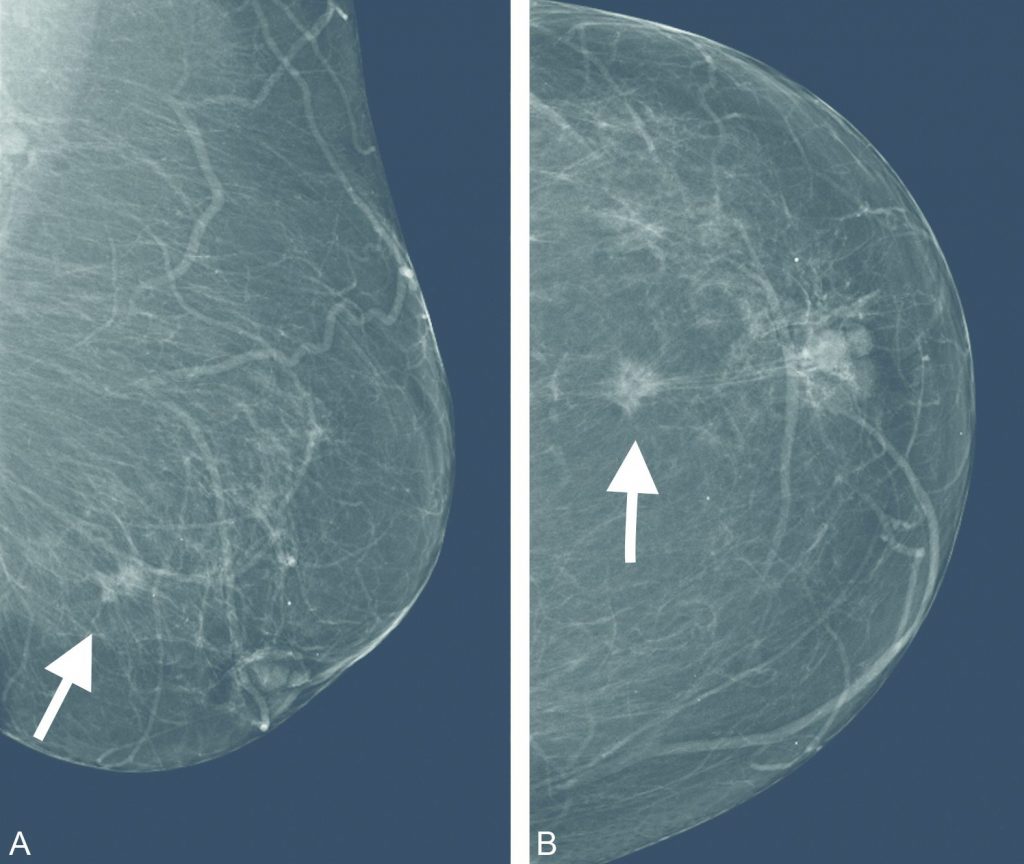
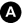
Fig. 34.8 Mammographie du sein gauche.
A. Incidence de face. B. Incidence oblique externe. Masse spiculée dense sus-mamelonnaire gauche centimétrique (flèche) avec rétraction mamelonnaire.
Source : CERF, CNEBMN, 2022.
B. En échographie

Les signes évocateurs de malignité d’une masse sont :
- les contours irréguliers, anguleux ou spiculés ;
- une orientation de la masse non parallèle à la peau ;
- une hypoéchogénicité marquée ou très hétérogène ;
- une atténuation postérieure.
Elle permet de différencier les cancers du sein des tumeurs bénignes, plus fréquentes chez des patientes jeunes, que sont les adénofibromes et les kystes :
- les kystes sont des masses liquidiennes strictes (anéchogènes avec renforcement postérieur) ;
- les fibroadénomes sont des masses d’échostructure hypoéchogène, homogènes, à limites bien nettes, de grand axe parallèle à la peau, sans atténuation postérieure.
C. En IRM

Les signes évocateurs de malignité sont : une masse en hyposignal T1, hypersignal T2, de forme irrégulière, de contours non circonscrits, présentant un rehaussement précoce avec lavage ou un rehaussement non-masse ou une distorsion d’architecture.
Les signes associés de malignité sont une rétraction mamelonnaire, une rétraction cutanée, un épaississement cutané, une infiltration du muscle pectoral.
D. En angiomammographie
Les signes évocateurs de malignité sont une masse de forme irrégulière, de contours spiculés, prenant le contraste, ou une distorsion architecturale prenant le contraste ou encore une prise de contraste non-masse.
E. En TEP-TDM au 18FDG
Les lésions tumorales apparaissent comme des hyperfixations ganglionnaires ou viscérales, correspondant à une accumulation pathologique de FDG.
Points clés
- L’imagerie indiquée pour le diagnostic comprend mammographie ± échographie.
- Le dépistage systématique gratuit par mammographie concerne les femmes entre 50 et 74 ans, tous les 2 ans.
- L’échographie mammaire est l’examen diagnostique de première intention de la femme de moins de 40 ans et de deuxième intention, après la mammographie, dans les autres cas.