Plan de chapitre
ITEM 18 – Santé et numérique
I. Définitions et histoire
– A. Définitions
– B. De la classification de photos sur internet à l’imagerie médicale
II. Applications
– A. Computer vision et analyse d’images
– B. Acquisition d’images
– C. Segmentation d’images
– D. Amélioration du flux de travail
– E. Radiologie interventionnelle
III. Intelligence artificielle et imagerie médicale : quels enjeux ?
Item, hiérarchisation des connaissances
ITEM 18 – Santé et numérique
| Rang | Rubrique | Intitulé |
| Définition | Connaître les supports numériques de la pratique clinique (sites généralistes et certification HON, bases de données, recommandations de bonnes pratiques, systèmes d’aide à la décision, entrepôts de données, techniques d’IA…) | |
| Définition | Expliquer les principes de l’intégration du numérique (traçabilité, dossier informatisé, prescription connectée, m-santé, aide à la décision, objets connectés, IA…) dans le parcours de soins, de la coordination des professionnels ainsi que de la gradation des soins | |
| Définition | Connaître les enjeux éthiques liés à la santé numérique | |
| Définition | Connaître l’impact potentiel de la santé numérique sur l’organisation des soins, de la recherche, ainsi que sur les métiers, les fonctions, les responsabilités des acteurs de santé | |
| Définition | Connaître les réglementations en matière de protection des donnés de santé et les enjeux juridiques liés à la santé numérique | |
| Définition | Connaître les bases du traitement de l’information en santé (codage, gestion, publication, évaluation) | |
| Prise en charge | Connaître les applications possibles des méthodes de traitements algorithmiques de données de santé (par exemple, big data, intelligence artificielle/apprentissage automatique) en santé sur le plan individuel et collectif | |
| Prise en charge | Comprendre la place et les implications de l’automesure numérique dans le suivi de la santé des personnes | |
| Prise en charge | Comprendre la place et les implications de la m-santé (applications mobiles) et des médias sociaux dans la communication interprofessionnelle et la santé des personnes | |
| Prise en charge | Savoir intégrer les outils d’aide à la décision en médecine dans sa pratique en étant capable d’en évaluer de façon critique l’apport, les risques et les contraintes (par exemple, de type SMR/ASMR) | |
| Suivi et/ou pronostic | Identifier les éléments clés nécessaires à l’usage des nouveaux outils du numérique (aspects juridiques, aspects organisationnels, aspects techniques, aspects pédagogiques patient et professionnel) |
I. Définitions et histoire
A. Définitions

L’intelligence artificielle (IA) est un domaine des sciences informatiques ayant pour objectif de créer des programmes réalisant des tâches normalement dévolues à l’intelligence humaine. L’IA ne reproduit pas le mécanisme de la cognition humaine (pensée) mais en imite les résultats (raisonnement, prise de décision…). Le terme d’intelligence artificielle a été introduit dans les années 1950 par le mathématicien anglais Alan Turing. De multiples applications utilisent désormais des algorithmes d’IA : reconnaissance faciale ou vocale, robotique humanoïde, analyse et prédiction des habitudes de catégories d’utilisateurs des réseaux sociaux… Y compris en médecine !
Un sous-domaine de l’intelligence artificielle est le « machine learning » (ou apprentissage automatique/machine) : il s’agit d’algorithmes qui apprennent par expérience à partir de données qui leur sont fournies. Un algorithme est une suite finie et non ambiguë d’opérations ou d’instructions permettant de résoudre une classe de problèmes. Les algorithmes d’IA, composés de fonctions mathématiques, vont être capables de réaliser diverses tâches, sans intervention humaine, c’est-à-dire sans y être explicitement programmées. En pratique, un jeu de données (« input ») est fourni à l’algorithme, et ses paramètres vont être optimisés afin de réaliser la tâche souhaitée (« output »). La tâche peut être :
- de la classification, pour prédire l’appartenance à une classe (par exemple, définir si une image correspond à un cancer ou à une lésion bénigne) ;
- de la régression, pour prédire une valeur quantitative (par exemple, prédire la survie d’un patient atteint de cancer) ;
- d’autres tâches comme la transcription (par exemple, la reconnaissance vocale), la synthèse de nouvelles images, le débruitage d’images, la détection d’anomalies (par exemple, des complications associées avec la prise d’un médicament)…
Pour réaliser ces tâches, l’algorithme utilise un processus d’apprentissage itératif à partir d’un jeu de données (« dataset ») dont on connaît déjà la classe ou la valeur quantitative (par exemple, à partir d’images médicales pour lesquelles on a déjà indiqué la classe « malin » ou la classe « bénin »). Il s’agit de la phase d’entraînement de l’algorithme, qui lui permet d’améliorer sa performance pour réaliser la tâche demandée, c’est-à-dire sa capacité à donner le bon résultat.
Une fois la phase d’apprentissage terminée, il sera possible de fournir de nouvelles données (par exemple, des photos d’animaux) dont on ne connaît pas la classe d’appartenance, mais pour lesquels l’algorithme entraîné pourra indiquer automatiquement la classe (par exemple, « chat ») avec de bonnes performances. L’algorithme a ainsi « appris » à prédire la classe de la photo, cette phase est appelée « inférence ».
Le « deep learning », ou apprentissage profond, est un sous-type d’apprentissage machine utilisant les algorithmes appelés « réseaux de neurones profonds », dont la structuration des fonctions mathématiques est inspirée de l’architecture neuronale du cerveau humain. La caractéristique des algorithmes de deep learning est d’avoir de très bonnes performances pour l’analyse des mégadonnées (« big data »), très complexes car contenant des milliers de variables différentes. Il est en conséquence nécessaire de disposer de grandes quantités de données et d’une importante puissance de calcul pour l’entraînement de ces algorithmes. C’est le développement récent de l’apprentissage profond qui a amené un regain d’intérêt pour l’IA en médecine, en particulier en imagerie médicale, car ces algorithmes réalisent certaines tâches de manière plus efficaces que ceux issus de l’apprentissage machine dit « classique », avec des performances suffisantes pour être utiles en routine clinique. En effet, une image médicale numérisée est constituée de milliers de pixels, correspondant à des milliers de variables, entrant ainsi dans la catégorie des données de grandes dimensions. La théorie mathématique des réseaux de neurones date aussi des années 1950, mais ce sont les développements récents en puissance de calcul, en architecture des réseaux et la disponibilité de jeux de données numériques qui ont permis son essor actuel.
B. De la classification de photos sur internet à l’imagerie médicale…

Le domaine du « computer vision » (vision assistée par ordinateur) est devenu une des applications principales de l’intelligence artificielle. D’énormes bases de données sur internet d’animaux (chats, chiens…) et d’objets (voitures, grille-pain…) ont permis de mettre en place des grands « challenges » ouverts au monde entier pour que les équipes (industriels, académiques, « geeks » indépendants) puissent rivaliser pour tester leurs algorithmes de reconnaissance d’images. ImageNet (ILSVRC, maintenant sur Kaggle), le challenge le plus connu et contenant une dizaine de millions d’images, a été bouleversé en 2012 par une équipe académique canadienne qui, grâce à un réseau de neurones profonds, a permis d’améliorer de 10 % les performances des meilleurs algorithmes qui plafonnaient à un taux d’erreur de 25 % ! Ces performances qui ne cessent de s’améliorer (2,3 % d’erreurs en 2017) ont permis d’envisager des applications qui relevaient jusque-là de la science-fiction, telles que la voiture autonome. Il n’a fallu qu’un pas pour que les réseaux de neurones profonds, capables de détecter ou reconnaître un objet dans une image, soient appliqués à l’imagerie médicale pour détecter (normal/anormal) ou caractériser (bénin/malin) les lésions. D’autant plus qu’une des caractéristiques de ces algorithmes est leur transférabilité d’une problématique à l’autre (« transfer learning »).
II. Applications

De multiples applications de l’intelligence artificielle sont attendues en imagerie, impactant la performance diagnostique des images, mais aussi la manière dont elles sont acquises, le flux de patients et le flux de lecture des examens (figure 131.1). D’autres développements pourront s’appliquer à la radiologie interventionnelle.
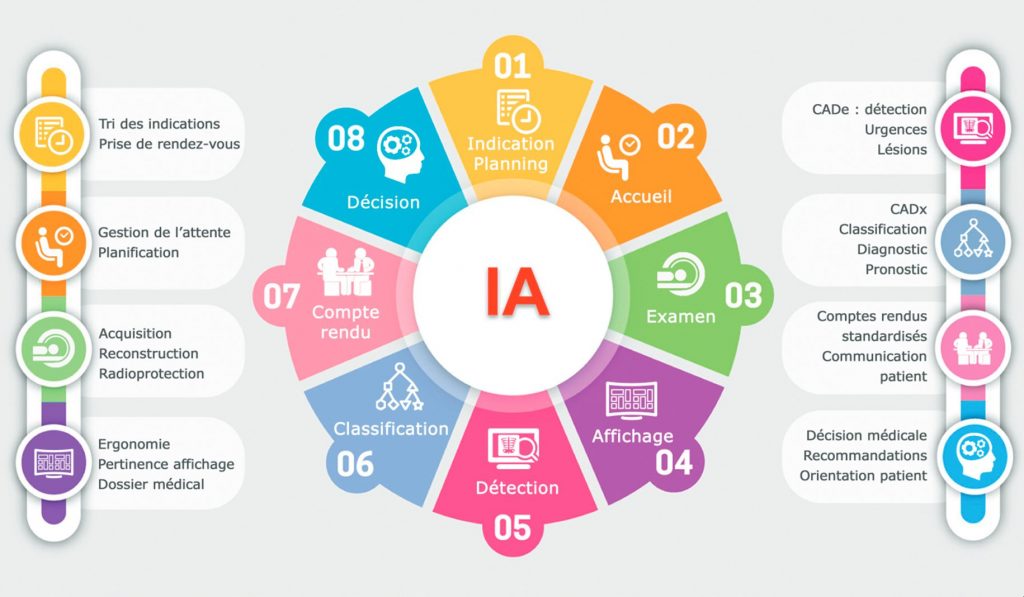

Fig. 131.1. Flux de travail en imagerie et applications possibles de l’intelligence artificielle à chaque étape.
Source : CERF, CNEBMN, 2022.
A. Computer vision et analyse d’images

La vision assistée par ordinateur et l’analyse d’images est l’application la plus souvent concernée par les logiciels d’IA en imagerie. Deux types d’algorithmes peuvent être développés (figure 131.2). Un algorithme de détection répond à la question : « Y a-t-il une lésion dans l’image ? » Ce sont par exemple des algorithmes qui seront appliqués au dépistage d’anomalies radiographiques. Un algorithme de caractérisation (dit de classification) répond à la question : « La lésion est-elle bénigne ou maligne ? » ou « Quelle est la nature de la lésion ? » Ces deux types d’algorithme peuvent être associés dans le même logiciel et des applications au dépistage de masse du cancer du sein en mammographie, au dépistage du cancer du poumon en scanner, à la détection de fractures sur les radiographies sont utilisées en pratique clinique.
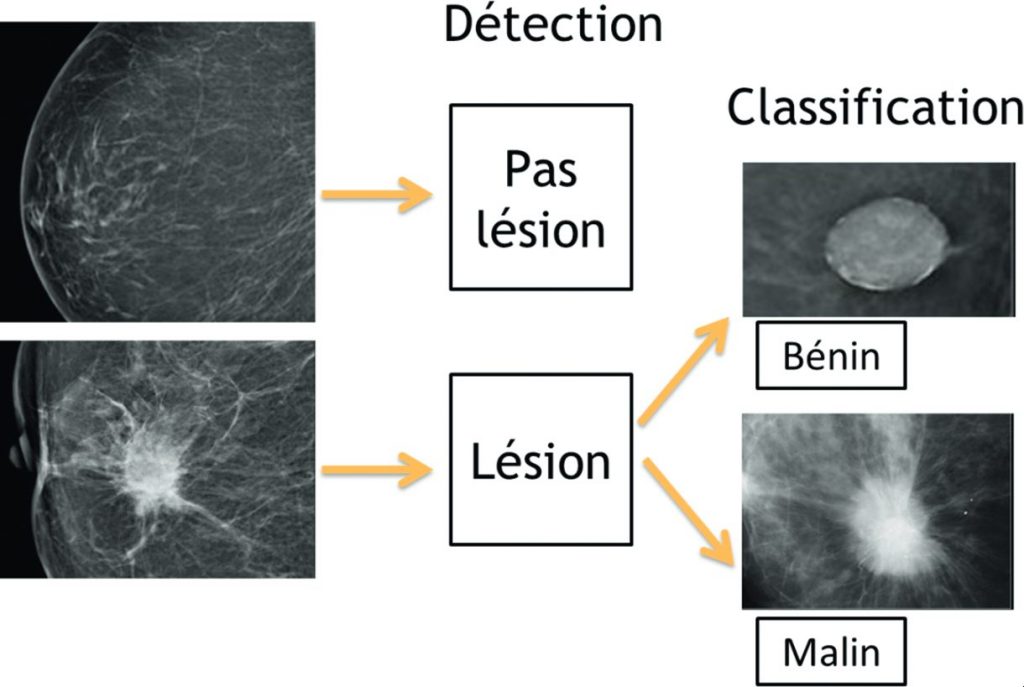

Fig. 131.2. Principes des algorithmes de détection et de classification appliqués à la mammographie.
Les algorithmes de détection permettront d’identifier s’il existe une lésion ou non. Les algorithmes de classification permettront d’estimer le risque qu’il s’agisse d’une lésion bénigne ou maligne.
Source : CERF, CNEBMN, 2022.
B. Acquisition d’images
Des algorithmes de débruitage des images sont déjà développés et implémentés sur des scanners ou IRM récents. Le principe est d’apprendre à l’algorithme à reconstituer une image de bonne qualité à partir d’une image très bruitée. Ainsi, des images de tomodensitométrie acquises à très basses doses d’irradiation peuvent être reconstruites pour donner des images de qualité diagnostique. Il est également possible de reconstruire des images post-injection de haute qualité à partir de scanners ou d’IRM réalisées avec des injections de très basses doses d’agent de contraste (10 % de la dose habituelle, par exemple), ou de TEP avec une faible dose de radiopharmaceutique. Enfin, il est possible de raccourcir la durée d’un examen IRM en acquérant des images de basse résolution spatiale ou en contraste, et ensuite reconstruire des images quasi identiques à celles d’acquisitions de haute résolution. Ainsi, les patients pourront avoir des examens de réalisation plus rapide, moins irradiants, et avec des doses d’agent de contraste réduites, diminuant les effets secondaires éventuels.
C. Segmentation d’images
Un domaine dans lequel les réseaux de neurones ont démontré leur supériorité est la segmentation automatique d’images. Par exemple, les cavités cardiaques et le myocarde du ventricule gauche peuvent être segmentés automatiquement par des logiciels à partir d’une IRM cardiaque dynamique aux phases télésystolique et télédiastolique, afin de calculer automatiquement la fraction d’éjection ou l’épaisseur du myocarde. Les vertèbres rachidiennes peuvent être automatiquement identifiées et numérotées, et la perte de la hauteur d’une ou plusieurs vertèbres par fracture-tassement peut être détectée. La quantité d’emphysème pulmonaire, le volume du parenchyme rénal, la perte de masse musculaire (sarcopénie, figure 131.3), les calcifications coronariennes peuvent également être fournies automatiquement au radiologue au début d’un examen, afin de l’aider à faire un bilan exhaustif et systématique de l’état de santé du patient.
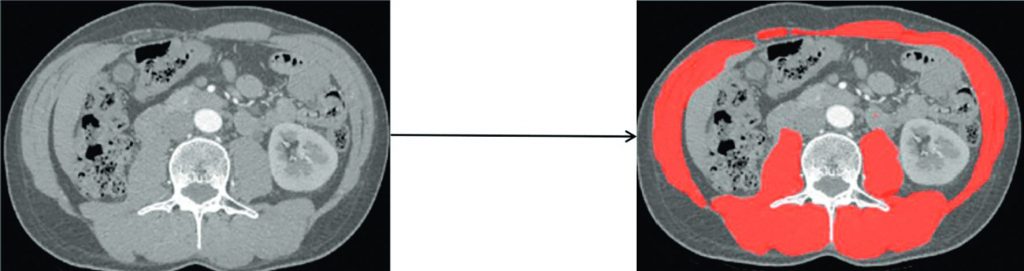

Fig. 131.3. Coupe axiale de scanner.
À gauche, une coupe axiale de scanner après injection chez un patient porteur d’un cancer, à hauteur de la vertèbre L3. Un algorithme fondé sur un réseau de neurones permet de délimiter (segmenter) les muscles de la paroi abdominale sur toute la circonférence : en avant et latéralement, les muscles grands droits, petits et grands obliques et transverses ; en arrière, les muscles psoas, carrés des lombes, épineux, longissimus du thorax et iliocostaux lombaires. La surface de ces muscles est rapportée à la taille au carré, définissant le Skeletal Muscle Index (SMI), dont la valeur, quand elle est basse, définit la sarcopénie.
Source : CERF, CNEBMN, 2022.
D. Amélioration du flux de travail
Au-delà de logiciels « intelligents » de gestion des rendez-vous en imagerie, plusieurs aspects du flux de travail des médecins nucléaires et radiologues font l’objet de développements grâce aux algorithmes d’intelligence artificielle.
La présentation de l’examen que le médecin doit interpréter peut être améliorée par des algorithmes en affichant les séries les plus appropriées en fonction de l’indication de l’examen. Des logiciels d’analyse du langage naturel pourraient aller chercher l’information pertinente dans le dossier médical du patient pendant la lecture de l’examen, pour noter par exemple un antécédent chirurgical.
Enfin, dans le cadre des urgences, des logiciels d’analyse d’images sont capables de détecter les pathologies les plus urgentes (saignement intracérébral, pneumopéritoine, fracture, embolie pulmonaire…). Ils signalent les examens anormaux, afin que le radiologue puisse les interpréter en priorité. Ceci permettrait de lire en priorité les examens des patients ayant des pathologies urgentes.
E. Radiologie interventionnelle
En radiologie interventionnelle, les outils d’intelligence artificielle permettront de mieux planifier la procédure, en particulier en guidant le choix du matériel, mais aussi en sélectionnant les patients qui auraient le plus de chance de bénéficier de la procédure.
Les méthodes de segmentation d’images et de recalage entre deux modalités auront pour conséquence de permettre en temps réel un repérage précis de l’organe et de la lésion à traiter. En effet, des images telles que l’IRM ou la TEP pourront être fusionnées avec les images des capteurs plans ou de radiologie conventionnelle, pour guider le radiologue au cours de la procédure.
La préparation de la procédure, le meilleur guidage jusqu’à la cible et le suivi en temps réel auront pour conséquence de réduire la dose de rayons X et d’agent de contraste injecté, au-delà des mêmes progrès en termes d’acquisition d’images qui sont attendus en radiologie diagnostique.
Enfin, des développements dans le domaine de la robotique sont attendus avec d’ores et déjà des prototypes de capteurs ultrasensibles et miniaturisés ou de microrobots intravasculaires permettant des procédures similaires à la chirurgie robotique.
III. Intelligence artificielle et imagerie médicale : quels enjeux ?
Une décennie après la révolution du deep learning dans le monde de la vision assistée par ordinateur, de nombreuses questions persistent, dont les problématiques de validation, de généralisation et d’explicabilité.
Ces algorithmes mathématiquement complexes sont difficiles à expliquer pour un cerveau humain ; on appelle cela l’effet « boîte noire ». Bien que puissants, ils peuvent aussi faire des erreurs qui paraissent grossières au cerveau humain, probablement en partie parce que les éléments de l’image qu’ils utilisent pour détecter ou classer sont une combinaison statistique complexe sans « logique » au sens humain du terme. C’est pourquoi la loi de bioéthique recommande pour l’instant la « garantie humaine », c’est-à-dire que tout algorithme ait son résultat validé par un être humain. Cette absence d’explicabilité des résultats d’un algorithme représente encore une limite pour l’acceptation des outils d’intelligence artificielle en imagerie, tant par le médecin que par le patient.
Les scientifiques ainsi que les autorités réglementaires n’ont pas encore déterminé quel serait le processus de validation de tels outils avant qu’ils puissent être utilisés en pratique clinique. En particulier, la généralisation de ces algorithmes est souvent problématique. Ajustés et très performants sur la population initiale sur laquelle ils ont été entraînés, les algorithmes sont souvent mis en échec quand on les applique à de nouveaux hôpitaux avec des caractéristiques de population, de machines d’imagerie ou de techniques d’acquisition différents.
Enfin, leur bénéfice réel dans le flux de travail du radiologue ou du médecin nucléaire, comme dans le parcours du patient, n’est pas encore démontré.
Points clés
- Les outils d’intelligence artificielle existent déjà dans les services d’imagerie, mais pour réaliser des tâches relativement simples, comme la segmentation ou la reconstruction d’images.
- Ces avancées sont en soi des bonds technologiques avec des bénéfices en termes de qualité d’image et d’interprétation.
- Les logiciels de diagnostic commencent à être proposés mais de nombreux enjeux persistent et la place qu’ils occuperont dans la routine du radiologue et du médecin nucléaire reste à déterminer.