Plan de chapitre
ITEM 108 – Confusion, démences
ITEM 109 – Troubles de la marche et de l’équilibre
ITEM 132 – Troubles cognitifs du sujet âgé
I. Généralités
II. Stratégie d’exploration en imagerie
– A. Objectifs de l’imagerie
– B. Indications des examens de médecine nucléaire
III. Sémiologie
– A. Hématome sous-dural chronique
– B. Hydrocéphalie chronique de l’adulte
– C. Démence vasculaire
– D. Maladie d’Alzheimer
Situations de départ
- 27 Chute de la personne âgée.
- 31 Perte d’autonomie progressive.
- 66 Apparition d’une difficulté à la marche.
- 114 Agitation.
- 117 Apathie.
- 119 Confusion mentale/désorientation.
- 129 Troubles de l’attention.
- 130 Troubles de l’équilibre.
- 131 Troubles de mémoire/déclin cognitif.
- 298 Consultation et suivi d’un patient ayant des troubles cognitifs.
Items, hiérarchisation des connaissances
ITEM 108 – Confusion, démences
| Rang | Rubrique | Intitulé | Descriptif |
| Éléments physiopathologiques | Comprendre le mécanisme physiopathologique de la confusion mentale* | ||
| Définition | Connaître la définition d’une confusion et d’une démence* | Description des principaux symptômes | |
| Étiologie | Connaître les principales causes neurologiques de confusion mentale* | Méningites, tumeurs, traumatismes, AVEC, épilepsie | |
| Étiologie | Connaître les principales causes non neurologiques de confusion mentale* | Toxiques, métaboliques, infectieuses | |
| Diagnostic positif | Savoir rechercher les causes de la confusion mentale | Démarche clinique : conduire l’examen clinique, décider de l’indication éventuelle d’une PL ou d’un scanner cérébral | |
| Prise en charge | Connaître les principes de la prise en charge thérapeutique d’un patient confus* | Faire les prescriptions d’urgence et traitement de la cause | |
| Éléments physiopathologiques | Connaître les principales lésions de la maladie d’Alzheimer (MA)* | Perte des neurones, accumulation protéine amyloïde, accumulation protéine tau | |
| Diagnostic positif | Connaître les manifestations cliniques de la MA aux différentes phases* | Phases prodromale, démentielle et de démence sévère | |
| Diagnostic positif | Connaître le profil des troubles de la mémoire de la MA* | Trouble de la consolidation en mémoire épisodique | |
| Diagnostic positif | Connaître les principaux diagnostics différentiels de la MA* | Confusion, causes fonctionnelles, causes organiques curables | |
| Prise en charge | Connaître les principes de prise en charge non médicamenteuse de la MA, y compris l’aide des réseaux ville-hôpital* | Aides humaines et financières, hygiène de vie, iatrogénie | |
| Éléments physiopathologiques | Préciser les principes du raisonnement topographique devant un syndrome démentiel* | Attention, fonctions d’intégration perceptive, mémoire et fonctions exécutives | |
| Examens complémentaires | Connaître les indications et les objectifs d’imagerie devant une démence ou une confusion | Démence : IRM cérébrale, à défaut TDM | |
| Examens complémentaires | Connaître la sémiologie en imagerie de l’hématome sous-dural chronique | Collection extraparenchymateuse à contenu liquidien, parfois associée à un saignement récent, habituellement en forme de « croissant », limitée par les sinus duraux, et assez souvent bilatérale | |
| Contenu multimédia | Exemple HSD chronique TDM | ||
| Examens complémentaires | Connaître la sémiologie en imagerie de l’hydrocéphalie chronique de l’adulte | ||
| Examens complémentaires | Connaître les indications des examens de médecine nucléaire dans les démences | Scintigraphie de perfusion cérébrale, scintigraphie des transporteurs de la dopamine, TEP au 18FDG | |
ITEM 109 – Troubles de la marche et de l’équilibre
| Rang | Rubrique | Intitulé | Descriptif |
| Diagnostic positif | Mener un interrogatoire devant un trouble de la marche* | ||
| Diagnostic positif | Savoir examiner un patient présentant un trouble de la marche* | Tester la posture, l’équilibre et la marche | |
| Diagnostic positif | Échelles d’analyse de l’équilibre et de la marche (examen clinique, démarche diagnostique)* | Échelles de Berg, tests de marche des 6 minutes, etc. | |
| Diagnostic positif | Connaître les caractéristiques cliniques des principales étiologies des troubles de la marche* | Origine douloureuse, ataxique (cérébelleuse, vestibulaire, proprioceptive), origine centrale (fauchage) et périphérique (steppage), déficitaire, à petits pas | |
| Diagnostic positif | Diagnostic d’une boiterie (examen clinique, démarche diagnostique)* | Éléments cliniques et vidéo en faveur d’une boiterie d’esquive, de salutation et de Trendelebourg | |
| Définition | Définition de l’astasie-abasie* | ||
| Étiologie | Étiologie de l’astasie-abasie* | ||
| Étiologie | Étiologie des démarches dandinantes* | ||
| Étiologie | Connaître le syndrome post-chute* | ||
| Étiologie | Savoir évoquer une étiologie somato-fonctionnelle devant un trouble de la marche et/ou de l’équilibre* | Connaître la marche du dépressif et conversif | |
| Contenu multimédia | Reconnaître les principaux troubles de la marche devant un cas vidéo* | ||
| Examens complémentaires | Indication et intérêt des examens d’imagerie devant un trouble de la marche ou de l’équilibre | ||
| Examens complémentaires | Citer les principaux examens complémentaires hors imagerie devant un trouble de la marche ou de l’équilibre* | Selon l’étiologie, EMG, biologie… | |
ITEM 132 – Troubles cognitifs du sujet âgé
| Rang | Rubrique | Intitulé | Descriptif |
| Définition | Définition trouble neurocognitif* | Définition du DSM-5 | |
| Diagnostic positif | Maladie d’Alzheimer* | Connaître les éléments cliniques positifs qui permettent de poser le diagnostic | |
| Diagnostic positif | Encéphalopathie vasculaire* | Connaître les éléments cliniques positifs qui permettent de poser le diagnostic | |
| Diagnostic positif | Maladie à corps de Lewy* | Connaître les éléments cliniques positifs qui permettent de poser le diagnostic | |
| Diagnostic positif | Diagnostic différentiel de la maladie d’Alzheimer et des maladies apparentées* | Connaître les maladies curables pouvant induire un trouble neurocognitif | |
| Étiologie | Connaître les causes principales d’un trouble neurocognitif* | ||
| Examens complémentaires | Connaître les outils de repérage d’un trouble neurocognitif* | Application en médecine générale | |
| Examens complémentaires | Connaître les examens de biologie à pratiquer devant un trouble neurocognitif* | Application des critères HAS 2011 | |
| Prise en charge | Prise en charge médicale d’un patient avec trouble neurocognitif* | Connaître les grandes lignes de la prise en charge médicale | |
| Prise en charge | Prise en charge psycho-sociale d’un patient avec trouble neurocognitif* | Connaître les grandes lignes de la prise en charge psycho-sociale | |
| Diagnostic positif | Symptômes psychologiques et comportementaux des démences* | Savoir identifier les principaux troubles du comportement associés aux maladies responsables d’un trouble neurocognitif | |
| Prise en charge | Démarche thérapeutique devant une agitation ou une agressivité dans un contexte de trouble neurocognitif* | Connaître les grands principes de la prise en charge hiérarchisée, médico-psycho-sociale et médicamenteuse | |
| Éléments physiopathologiques | Maladie d’Alzheimer* | Connaître les grandes lignes de la physiopathologie de la maladie d’Alzheimer | |
| Diagnostic positif | Dégénérescence lobaire fronto-temporale* | Connaître les éléments cliniques positifs qui permettent de poser le diagnostic | |
| Examens complémentaires | Connaître les grandes lignes des résultats attendus de l’IRM devant un trouble neurocognitif | Application des critères HAS 2011 | |
| Contenu multimédia | Exemple HSD chronique TDM | ||
I. Généralités
Selon la classification DSM-IV, la démence est définie comme un déclin significatif par rapport au niveau de fonctionnement antérieur, notamment socioprofessionnel, secondaire à l’apparition de déficits cognitifs multiples non liés exclusivement à une confusion mentale et associant une altération de la mémoire et au moins une des perturbations suivantes : aphasie, agnosie, apraxie, perturbations des fonctions exécutives.
La maladie d’Alzheimer est la cause de démence la plus fréquente chez le sujet âgé. Viennent ensuite, parmi les étiologies neurodégénératives, la maladie à corps de Lewy et la démence frontotemporale. La dépression et la confusion sont les principaux diagnostics différentiels. De nombreuses pathologies peuvent s’accompagner de lésions encéphaliques responsables d’une démence secondaire : démence vasculaire, sclérose en plaques, sida, tuberculose, hypertension artérielle, maladies métaboliques.
II. Stratégie d’exploration en imagerie
Selon les recommandations de la Haute Autorité de Santé (2011) et le Guide du bon usage des examens d’imagerie (2013) : « Une IRM est recommandée chez tout patient présentant des troubles cognitifs. Cet examen permet d’éliminer une cause curable de démence et d’orienter le diagnostic étiologique vers une démence dégénérative ou vasculaire (…), à défaut, un scanner cérébral pourra être envisagé afin d’éliminer un diagnostic différentiel. »
A. Objectifs de l’imagerie

Ils sont de rechercher :
- une cause susceptible de bénéficier d’un traitement neurochirurgical (tumeur intracrânienne, par exemple un méningiome frontal, hématome sous-dural chronique, hydrocéphalie chronique) ;
- des lésions vasculaires (AVC multiples, lacunes profondes, microangiopathie sévère) ;
- des éléments en faveur d’une maladie neurodégénérative :
- atrophie hippocampique/temporale/pariétale postérieure dans la maladie d’Alzheimer ;
- autres atrophies lobaires, atrophie des noyaux gris centraux, atteinte corticale et/ou des noyaux gris centraux en IRM de diffusion dans la maladie de Creutzfeldt-Jakob.
B. Indications des examens de médecine nucléaire
Ils sont limités à :
- imagerie du métabolisme cérébral en TEP au 18FDG à la recherche d’un hypométabolisme cérébral :
- dans le diagnostic précoce de la maladie d’Alzheimer (stade prodromal) ;
- dans les présentations atypiques de la maladie d’Alzheimer, en cas de doute diagnostique avec une démence frontotemporale ou une autre atrophie lobaire ;
- une scintigraphie du transporteur de la dopamine (TEMP au 123I-ioflupane ou DaTSCAN® ou une TEP à la 18F-DOPA) à la recherche d’une dénervation dopaminergique nigrostriée en cas de doute diagnostique entre maladie d’Alzheimer et démence à corps de Lewy.
III. Sémiologie
A. Hématome sous-dural chronique
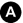
Collection extraparenchymateuse à contenu liquidien, parfois associée à un saignement récent, habituellement en forme de « croissant », limitée par les sinus duraux, et assez souvent bilatérale (figure 53.1).
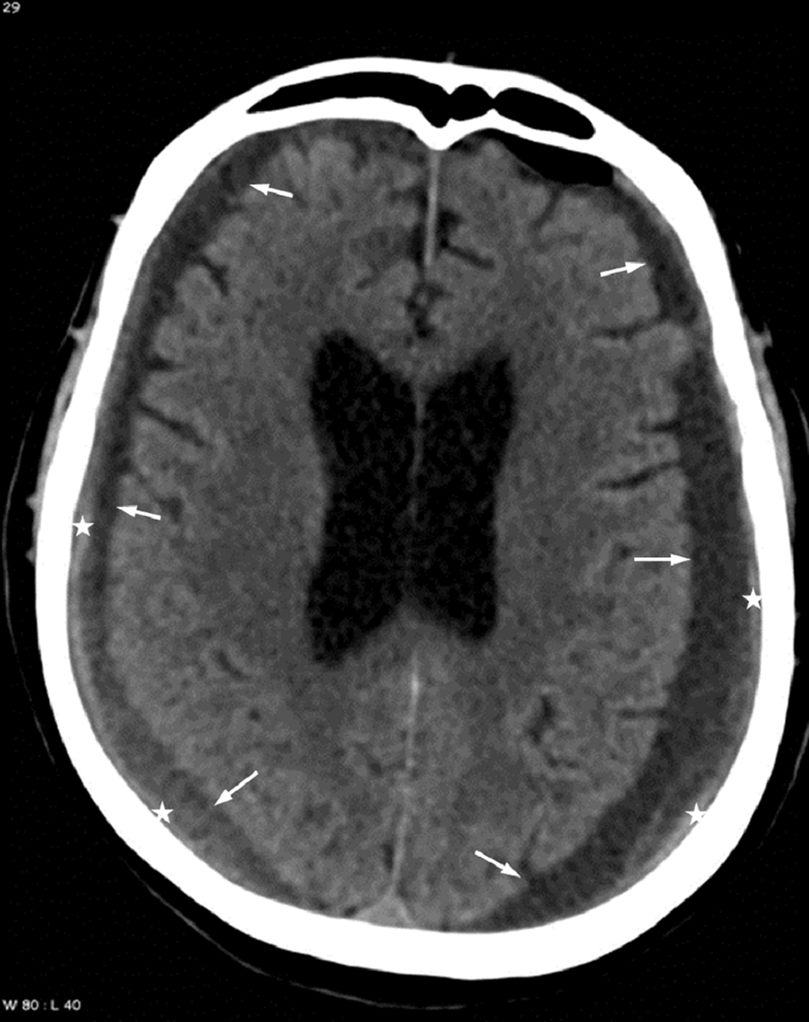
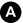
Fig. 53.1. Hématome sous-dural chronique bilatéral.
Scanner sans injection de produit de contraste iodé en coupe axiale. Collections de densité liquidienne bilatérales le long de la voûte crânienne, en forme de « croissants » (flèches), avec remaniements hémorragiques récents (discrète hyperdensité déclive, ∗) prédominant à droite.
Source : CERF, CNEBMN, 2022.
B. Hydrocéphalie chronique de l’adulte

Dilatation globale du système ventriculaire plus marquée que l’élargissement des espaces sous-arachnoïdiens des convexités (figure 53.2). Pas d’obstacle focal sur le circuit du liquide cérébrospinal ni de signe d’hypertension intracrânienne.
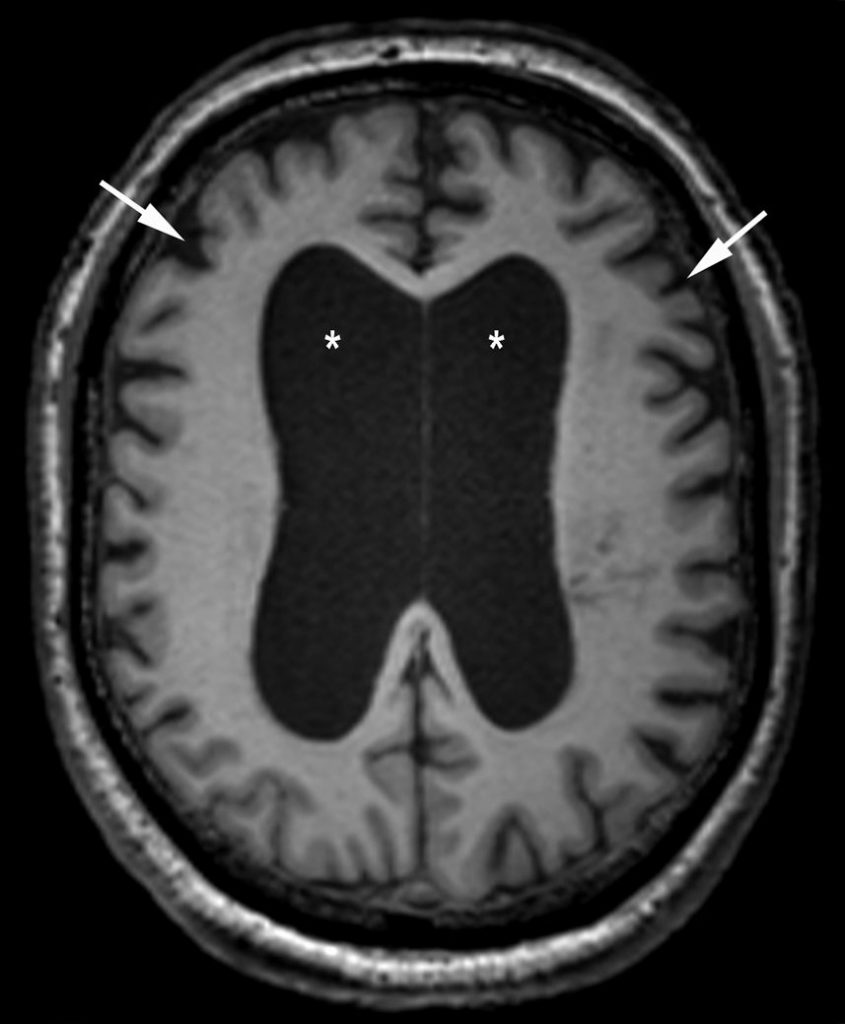

Fig. 53.2. Hydrocéphalie chronique de l’adulte.
L’IRM cérébrale en coupe axiale en T1 sans injection de gadolinium montre une dilatation du système ventriculaire (∗) plus importante que l’élargissement des espaces sous-arachnoïdiens des convexités (flèches).
Source : CERF, CNEBMN, 2022.
C. Démence vasculaire
Séquelles d’AVC multiples ou de topographie stratégique et/ou microangiopathie sévère associant des lésions en hypersignal en T2/FLAIR du parenchyme cérébral (figure 53.3).
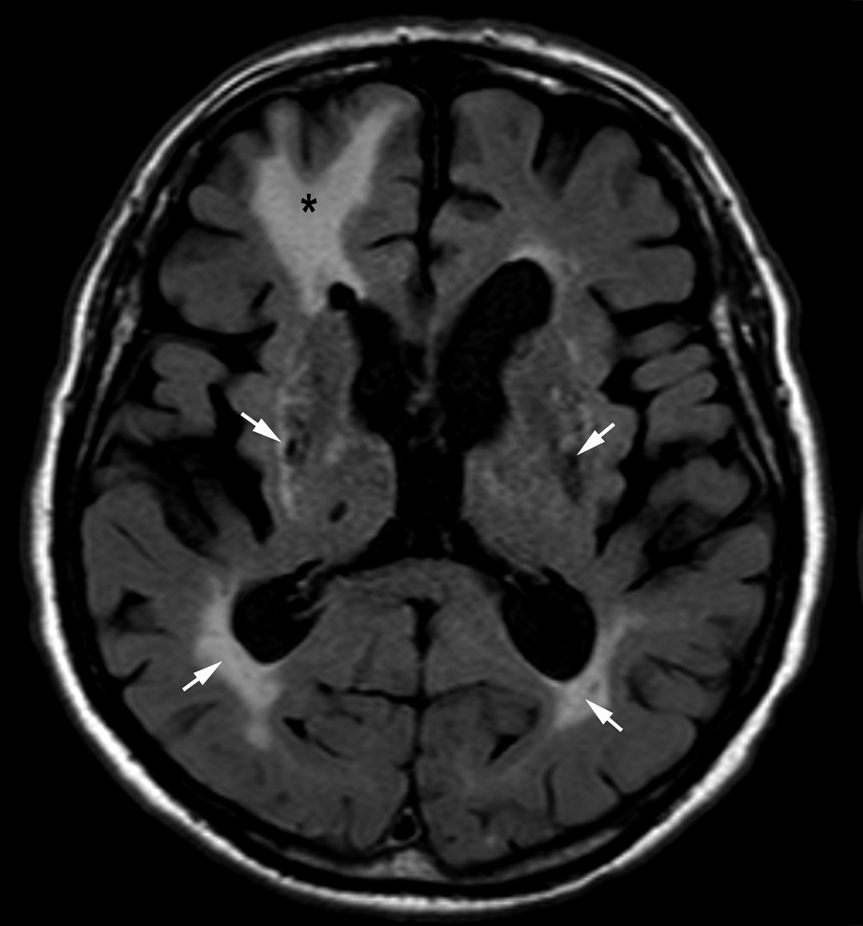

Fig. 53.3. Démence vasculaire.
L’IRM cérébrale en coupe axiale en FLAIR montre de multiples hypersignaux non spécifiques de la substance blanche associés à des lacunes périventriculaires et des noyaux gris centraux (flèches) ainsi qu’à des séquelles d’AVC (∗).
Source : CERF, CNEBMN, 2022.
D. Maladie d’Alzheimer
Atrophie corticale à la face médiale des lobes temporaux : cortex entorhinal (T5, gyrus parahippocampique) puis hippocampe. Cette atrophie est visible sous forme d’un élargissement des espaces liquidiens adjacents (espaces sous-arachnoïdiens et fissure choroïde, corne temporale des ventricules latéraux) (figure 53.4). Une échelle d’atrophie temporale interne, l’échelle de Scheltens, est utilisée en pratique pour évaluer visuellement cette atrophie ; elle est fondée sur la hauteur de la formation hippocampique, la largeur de la fissure choroïdienne et la largeur de la corne temporale. L’atrophie peut parfois débuter en frontal ou pariétal. Une atrophie corticale pariétale postérieure est associée précocement.

Fig. 53.4. IRM cérébrale en coupes coronales orthogonales aux hippocampes (flèches), pondérées en T1, chez un homme sain de 70 ans (A, B) et chez un homme du même âge suivi pour maladie d’Alzheimer (C, D).
Dans le cas de la maladie d’Alzheimer, les hippocampes sont de petite taille par rapport à des hippocampes normaux et les sillons et les ventricules sont dilatés.
Source : CERF, CNEBMN, 2022.

La TEP au 18FDG met en évidence un hypométabolisme et une hypoperfusion prédominant au niveau du cortex associatif pariétotemporal et des structures temporales internes (figure 53.5), à la différence de la démence frontotemporale, pour laquelle les anomalies touchent le cortex frontal et les pôles temporaux (figure 53.6).
Il existe des biomarqueurs dans le liquide cérébrospinal (protéines tau, peptides amyloïdes β40 et β42).
La scintigraphie du transporteur de la dopamine est normale dans la maladie d’Alzheimer ; en revanche, il existe une diminution de la fixation du 123I-ioflupane et de la 18F-DOPA sur les striata dans la démence à corps de Lewy.
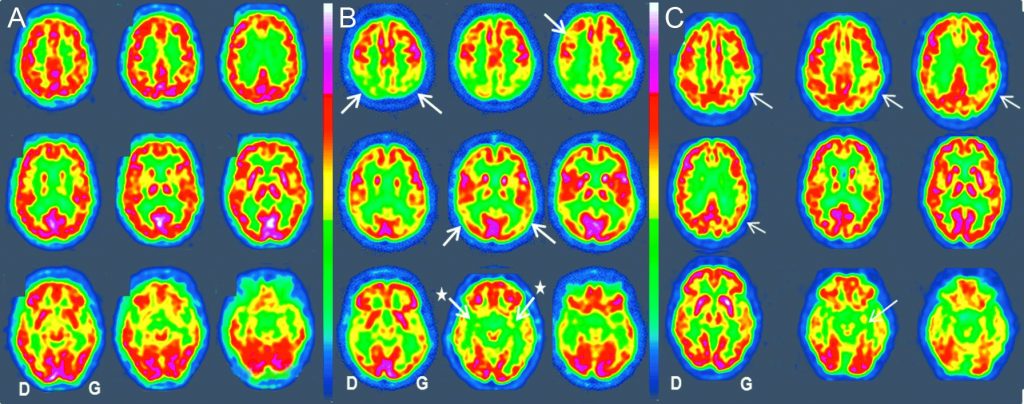

Fig. 53.5. TEP au 18FDG en coupes axiales.
Métabolisme cortical normal (A). Maladie d’Alzheimer au stade de démence (B) : hypométabolisme sévère du cortex pariéto-temporo-occipital bilatéral (flèches) et des structures amygdalo-hippocampiques (étoiles). Maladie d’Alzheimer au stade prodromal (C) : hypométabolisme cortical modéré se limitant au cortex pariétotemporal gauche (flèches). Hypométabolisme temporal interne bilatéral.
Source : CERF, CNEBMN, 2022.
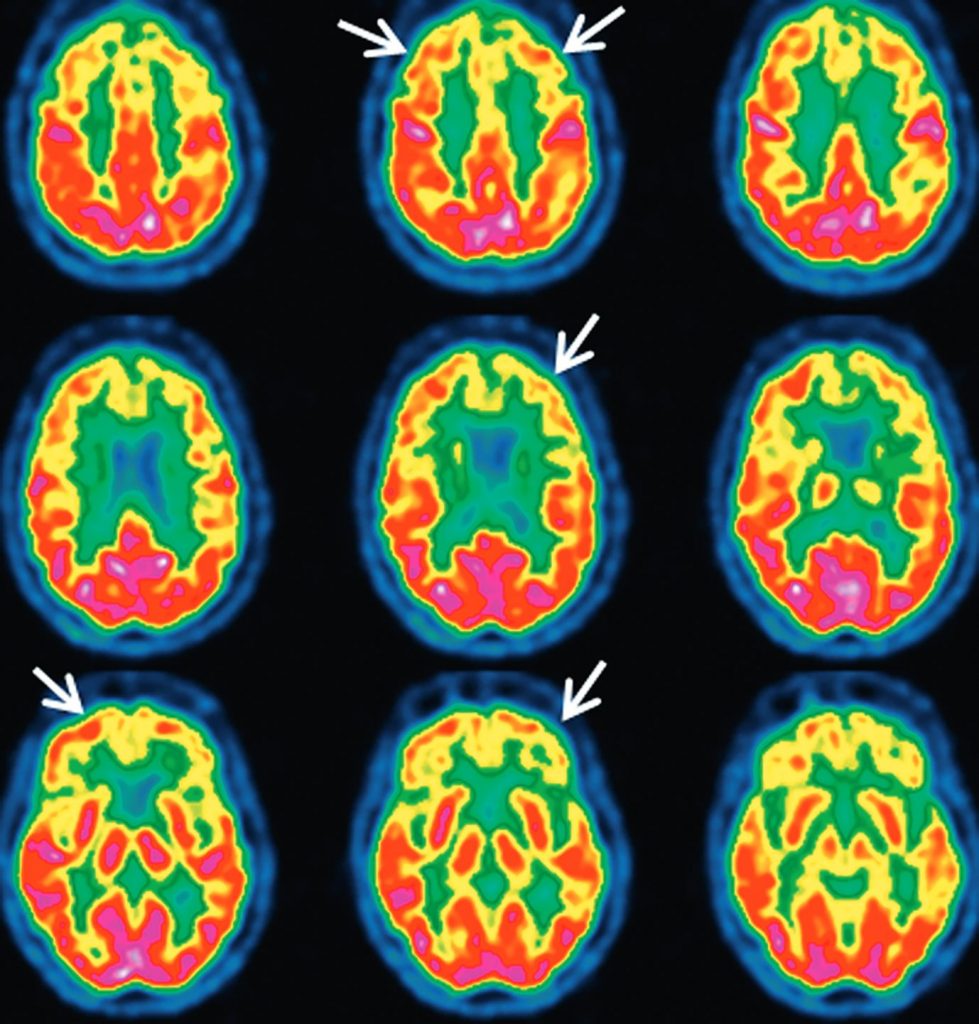

Fig. 53.6. TEP au 18FDG dans la démence frontotemporale : hypométabolisme étendu du cortex préfrontal bilatéral (flèches).
Source : CERF, CNEBMN, 2022.
Points clés
- Une IRM cérébrale est recommandée pour toute démence de découverte récente.
- Cette IRM permet d’éliminer les causes curables, de faire le bilan des lésions vasculaires et d’orienter vers une maladie neurodégénérative par l’analyse de la localisation des atteintes.
- L’imagerie TEMP de perfusion cérébrale ou TEP du métabolisme cérébral permet d’orienter vers une cause neurogénérative de la démence et aider à sa catégorisation.
- L’imagerie TEMP ou TEP du transporteur de la dopamine peut être réalisée en cas de doute diagnostique entre maladie d’Alzheimer et démence à corps de Lewy.
Références