Plan de chapitre
ITEM 310 – Tumeurs de la prostate
I. Généralités
– A. Épidémiologie
– B. Facteurs de risque
– C. Histologie
– D. Extension locale, régionale et métastatique du cancer de prostate
– E. Présentation clinique
II. Stratégie diagnostique du cancer de prostate
– A. Absence de dépistage de masse
– B. Diagnostic individuel
III. Stratégie d’exploration en imagerie du cancer de prostate
– A. Détection du cancer
– B. Bilan d’extension lymphatique et osseux C. Suivi post-thérapeutique
Situations de départ
- 95 Découverte d’une anomalie au toucher rectal
- 229 Découverte d’une anomalie pelvienne à l’examen d’imagerie médicale
- 303 Prévention/dépistage des cancers de l’adulte
Item, hiérarchisation des connaissances
ITEM 310 – Tumeurs de la prostate
| Rang | Rubrique | Intitulé | Descriptif |
| Définition | Connaître les principales lésions bénignes et malignes de la prostate | Hyperplasie prostatique bénigne (adénomyomateuse), adénocarcinome | |
| Prévalence, épidémiologie | Connaître l’épidémiologie du cancer de la prostate | Connaître la prévalence, les rangs de classement du cancer de la prostate par rapport aux principaux cancers, en termes d’incidence et de mortalité du cancer de la prostate, l’âge de pic de fréquence et les élements pronostiques | |
| Étiologie | Connaître les principaux facteurs de risque du cancer de la prostate | Savoir citer les facteurs de risque reconnus ; savoir qu’il n’y a pas de chimioprévention dans le cancer de la prostate | |
| Éléments physiopathologiques | Connaître le mode d’extension du cancer de la prostate | Connaître le modalités d’extension locale, les principales voies lymphatiques et sites de dissémination métastatique | |
| Diagnostic positif | Connaître les grandes présentations cliniques du cancer de la prostate | Savoir que la plupart des cancers de la prostate sont asymptomatiques, savoir suspecter un cancer de la prostate à sa forme avancée devant un tableau de rétention urinaire, d’insuffisance rénale, de métastases osseuses diffuses, savoir que l’hémospermie n’est pas un signe de cancer de la prostate | |
| Examens complémentaires | Connaître les examens paracliniques de première intention devant une suspicion de cancer de la prostate ; règles de bon usage du dosage de PSA | Connaître le dosage de PSA et ses règles de bon usage et de pertinence pour le diagnostic individuel précoce | |
| Prise en charge | Connaissances générales sur les différentes prises en charge au stade localisé | Connaître la modalité d’abstention-surveillance chez les patients fragiles, de surveillance active et son rapport bénéfice/risque, de prostatectomie radicale et son rapport bénéfice/risque, de radiothérapie externe et son rapport bénéfice/risque, de prise en charge par curiethérapie interstitielle et son rapport bénéfice/risque, de prise en charge par ultrasons focalisés et photothérapie dynamique |
I. Généralités
A. Épidémiologie

Le cancer de la prostate est le cancer le plus fréquent chez l’homme de plus de 60 ans. Le nombre de nouveaux cas observés était de 50 484 cas en 2015 (INCa). Il représente la troisième cause de mortalité par cancer chez l’homme (8 512 décès en 2015).
B. Facteurs de risque
L’âge, les facteurs génétiques et l’ethnie sont les principaux facteurs de risque du cancer de prostate. Le cancer de la prostate est un cancer pour lequel le poids de l’hérédité est prépondérant, les antécédents familiaux représentant le facteur de risque le plus puissant. Il existe deux types de prédisposition génétique au cancer de la prostate : l’hérédité monogénique, rare (5 % des cas), et l’hérédité polygénique, prédominante (95 % des cas).
Aux Antilles françaises, l’incidence du cancer de la prostate et sa mortalité sont deux fois plus élevées par rapport à la France métropolitaine.
Il n’existe pas à ce jour de chimioprévention dans le cancer de la prostate.
C. Histologie

L’adénocarcinome représente la forme histologique de loin la plus fréquente des cancers de la prostate. Sa classification histologique repose sur le score de Gleason. Il existe cinq grades de Gleason (numérotés de 1 à 5) qui traduisent une dédifférenciation cellulaire et une désorganisation glandulaire de plus en plus grande. Le score de Gleason additionne les deux grades les plus représentés dans la tumeur. Si la tumeur est monomorphe (un seul grade), celui-ci est doublé pour obtenir le score. Plus le score est élevé, plus la tumeur est de mauvais pronostic. Le grade prédominant est cité en premier dans le score ; ainsi, un score de Gleason 7 (3 + 4) est moins grave qu’un score de Gleason 7 (4 + 3). En théorie, le score peut aller de 2 à 10 ; en pratique, les grades 1 et 2 ne sont quasi pas rencontrés et le score va donc de 6 à 10. Récemment, la Société internationale d’uropathologie (ISUP) a regroupé les scores de Gleason en « groupes ISUP » (tableau 30.1).
Tableau 30.1 Groupes pronostiques de la classification ISUP 2016.
| Groupe 1 | Anciennement score de Gleason 6 (3 + 3) |
| Groupe 2 | Score de Gleason 7 (3 majoritaire) |
| Groupe 3 | Score de Gleason 7 (4 majoritaire) |
| Groupe 4 | Score de Gleason 8 (4 + 4, 3 + 5, ou 5 + 3) |
| Groupe 5 | Score de Gleason 9 ou 10 |
D. Extension locale, régionale et métastatique du cancer de prostate
Extension locale :
- extension à l’espace périprostatique (franchissement capsulaire), stade T3a ;
- extension aux vésicules séminales, stade T3b ;
- extension au col vésical, au rectum, stade T4.
- Extension régionale : envahissement ganglionnaire fréquent ; les premiers relais ganglionnaires sont les ganglions ilio-obturateurs puis iliaques, latéro-aortiques et latéro-caves.
- Extension à distance : le cancer de prostate est ostéophile, les métastatses osseuses siègent habituellement au niveau des vertèbres, du bassin, des côtes des os longs et du crâne.
D. Extension locale, régionale et métastatique du cancer de prostate
Extension locale :
- extension à l’espace périprostatique (franchissement capsulaire), stade T3a ;
- extension aux vésicules séminales, stade T3b ;
- extension au col vésical, au rectum, stade T4.
- Extension régionale : envahissement ganglionnaire fréquent ; les premiers relais ganglionnaires sont les ganglions ilio-obturateurs puis iliaques, latéro-aortiques et latéro-caves.
- Extension à distance : le cancer de prostate est ostéophile, les métastatses osseuses siègent habituellement au niveau des vertèbres, du bassin, des côtes des os longs et du crâne.
E. Présentation clinique
Le cancer de prostate est majoritairement asymptomatique (tumeur de petit volume sans répercussion locale).
Plus rarement, la progression locorégionale domine : le patient se présente avec des troubles fonctionnels urinaires en rapport avec une atteinte de l’urètre, avec dysurie et rétention urinaire, puis une atteinte urétérale avec urétéro-hydronéphrose.
Enfin, le stade métastatique avec des douleurs osseuses qui doivent faire rechercher une extension osseuse.
II. Stratégie diagnostique du cancer de prostate
A. Absence de dépistage de masse
De nombreux hommes — une proportion substantielle difficile à estimer, mais peut-être supérieure à 50 % — de plus de 60 ans ont dans leur prostate des microfoyers de cancers dits « indolents » (de groupe ISUP 1) qui ne menaceront jamais leur vie.
Il existe donc une controverse sur l’intérêt du dépistage de masse du cancer de la prostate, d’autant que les traitements curateurs (chirurgie ou radiothérapie) ont des effets secondaires fréquents et invalidants (représentés principalement par l’incontinence urinaire et l’impuissance). La problématique est donc de limiter la détection précoce au cancer de la prostate agressif, chez un patient ayant été mis au courant des effets secondaires potentiels des traitements et qui n’a pas de comorbidité qui menace sa vie à plus court terme que le cancer. On parle de dépistage individuel (par opposition au dépistage de masse).
B. Diagnostic individuel
Une détection précoce du cancer de la prostate doit être effectuée chez les hommes ayant une survie estimée au minimum à 10 ans, ayant été informés de façon loyale et ayant donné leur accord pour la procédure, afin de s’assurer qu’elle corresponde à leurs attentes. L’information doit porter à la fois sur la détection, le diagnostic, mais aussi sur les modalités thérapeutiques du cancer de la prostate, intégrant la surveillance active et les éventuelles séquelles des prises en charge.
La détection doit s’envisager chez des hommes chez lesquels l’incidence de la maladie est significativement élevée, c’est-à-dire les hommes âgés de 50 ans voire 40 ans, a fortiori s’ils ont des antécédents familiaux de cancer de la prostate ou sont d’origine africaine ou afro-caribéenne.
La détection précoce repose sur le toucher rectal et le dosage du PSA (Prostate Specific Antigen) et un interrogatoire à la recherche des facteurs de risque familiaux. Le PSA est une enzyme prostatique qui augmente de façon non spécifique pour toute pathologie prostatique bénigne (HBP, inflammation, infection) ou maligne (cancer).
Depuis 2019, les recommandations nationales (AFU, Association française d’urologie) et européennes (EAU, European Association Urology) ont changé. Jusqu’en 2019, une anomalie au toucher rectal ou une élévation du taux de PSA supérieure à 4 ng/ml conduisait à discuter la réalisation de biopsies prostatiques échoguidées (douze biopsies randomisées), pour poser le diagnostic de cancer de la prostate. Dorénavant, tout patient ayant une suspicion clinique de cancer de prostate doit bénéficier d’une IRM prostatique avant la réalisation des biospies.
Les résultats de l’IRM permettent de déterminer le schéma de réalisation des biopsies prostatiques :
- en cas de positivité de l’examen (défini avec un score PI-RADS de 3, 4 ou 5, cf. infra), des biopsies ciblées sur la lésion identifiée doivent être réalisées en plus des biopsies randomisées. Les biopsies ciblées par l’IRM permettent une meilleure détection et caractérisation du cancer de prostate ;
- en cas de négativité de l’IRM (PI-RADS 1 et 2), les biopsies systématiques seules sont recommandées. Cependant, dans certaines circonstances, en particulier si le risque de cancer de prostate est faible, et après information du patient, il est possible de surseoir aux biopsies si l’IRM est négative et que le taux de PSA rapporté au volume prostatique (densité de PSA) est bas ≤ 0,15 ng/ml/ml.
III. Stratégie d’exploration en imagerie du cancer de prostate
A. Détection du cancer
1. Échographie

L’échographie endorectale de la prostate permet uniquement de mesurer le volume prostatique, d’évaluer le résidu post-mictionnel et de guider les biopsies randomisées pour leur permettre d’être réparties harmonieusement dans la glande.
Sémiologie échographique
En échographie, le cancer de prostate peut apparaître sous la forme d’une lésion hypoéchogène et hypervasculaire en doppler couleur (figure 30.1). Cependant, l’échographie n’est ni sensible ni spécifique et ne doit pas être utilisée comme moyen diagnostique isolé du cancer de prostate.
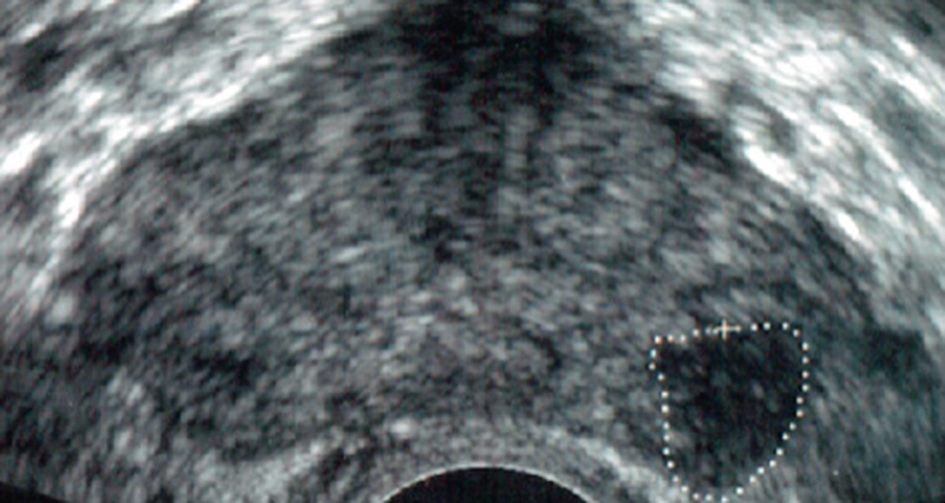

Fig. 30.1 Échographie d’un adénocarcinome prostatique Gleason 7.
Le cancer de la prostate (pointillés) se situe ici dans la zone périphérique, au niveau du secteur latéral du lobe gauche de la prostate, et apparaît sous la forme d’une plage hypoéchogène par rapport à la zone périphérique adjacente. Cet aspect n’est pas spécifique mais peut constituer une cible lors de la biopsie échoguidée si celle-ci est indiquée.
Source : CERF, CNEBMN, 2022.
2. IRM prostatique
L’IRM multiparamétrique de prostate (associant des séquences pondérées en T2, en diffusion et des séquences en pondération T1 après injection de chélates de gadolinium) permet de localiser les zones suspectes et de mieux diagnostiquer les cancers agressifs en associant des biopsies « ciblées » (sur les zones suspectes) aux biopsies « systématiques » (faites au hasard). Le compte rendu de l’IRM prostatique est standardisé avec l’attribution d’un score PI-RADS (Prostate Imaging Report and Data System) pour chaque lésion identifiée. Le score PI-RADS va de 1 à 5 et prédit la présence d’un cancer significatif de la prostate (présence de grade 4). L’IRM permet dans le même temps de faire le bilan d’extension locale et régionale du cancer.
En IRM (figure 30.2), le cancer de la prostate apparaît :
- en hyposignal sur la séquence T2 ;
- en restriction de diffusion (comme la plupart des cancers) en hyposignal sur la carte ADC (la carte du coefficient apparent de diffusion) et en hypersignal sur la séquence de diffusion ;
- hypervascularisé, se rehaussant précocement par rapport au reste de la zone périphérique prostatique sur la séquence T1 avec injection.
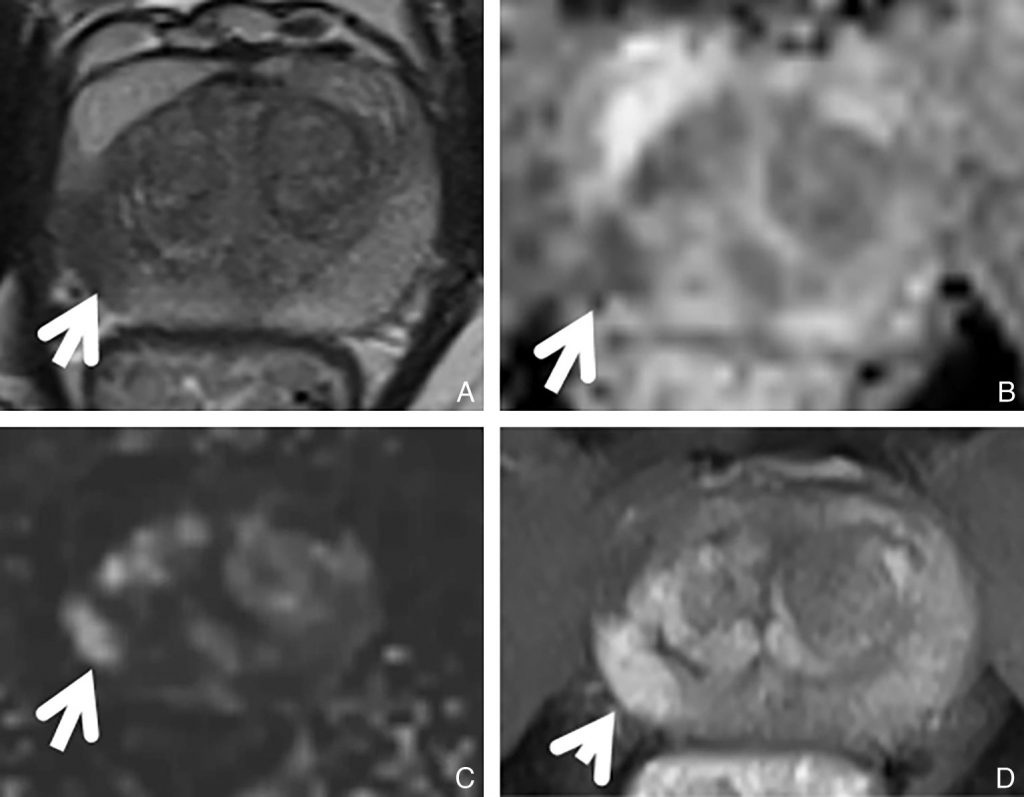

Fig. 30.2 IRM prostatique d’un adénocarcinome prostatique Gleason 7 du lobe droit.
Le cancer de la prostate (flèche) apparaît en hyposignal sur la séquence T2 (A). Il présente une restriction de diffusion visible en hyposignal sur la carte du coefficient apparent de diffusion (B), en hypersignal sur la séquence de diffusion, (C) et se rehaussant précocement par rapport au reste de la zone périphérique prostatique sur la séquence T1 avec injection de gadolinium (D).
Source : CERF, CNEBMN, 2022.
B. Bilan d’extension lymphatique et osseux
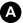
Il est recommandé en cas de risque intermédiaire ou élevé :
- pour la recherche de métastases osseuses, la scintigraphie osseuse pour le bilan d’extension initial des patients à risque intermédiaire d’Amico en cas de grade 4 majoritaire dans le score de Gleason (figure 30.3) ;
Fig. 30.3 Scintigraphie osseuse. Balayage « corps entier » (A), coupe axiale TDM (B) et coupe axiale TEMP-TDM (C).
Bilan d’extension initial d’un adénocarcinome prostatique (Gleason 4 + 4 avec un taux de PSA à 11,8 ng/ml) retrouvant une hyperactivité ostéoblastique suspecte de lésion secondaire de la tête fémorale gauche (A, flèche rouge).
Source : CERF, CNEBMN, 2022.
- pour la recherche de métastases viscérales et ganglionnaires le scanner thoraco-abdomino-pelvien ;
la TEP à la fluorocholine (18FCH), qui peut être proposée pour le bilan d’extension initial des patients à haut risque de récidive et en intention de traitement curatif (figure 30.4).
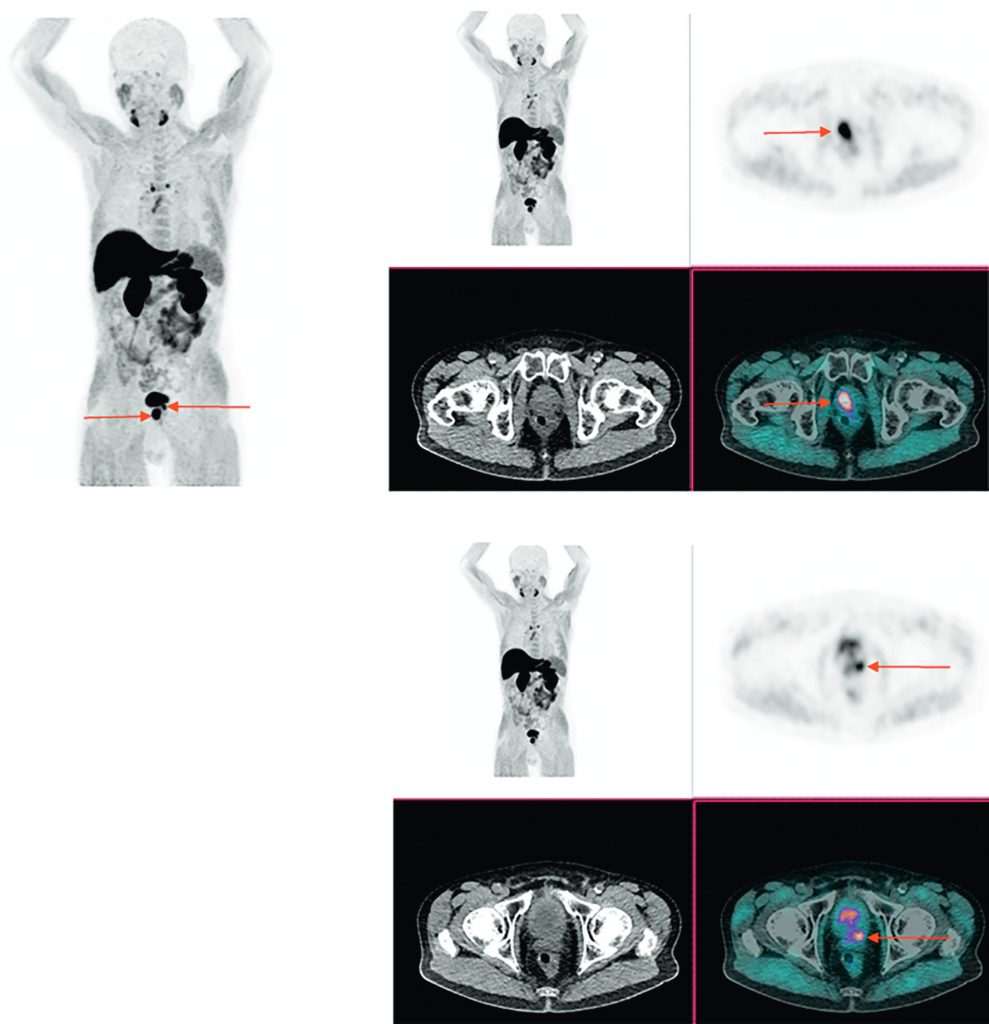

Fig. 30.4 TEP-TDM à la 18FCH. MIP 3D et coupe axiales TEP, TDM et TEP-TDM centrées sur la prostate.
Bilan d’extension initial d’un patient présentant un adénocarcinome prostatique avec un score de Gleason 4 + 4. Images mettant en évidence un hypermétabolisme des lésions prostatiques bilatérales (flèches rouges), sans hypermétabolisme suspect de lésion secondaire à distance.
Source : CERF, CNEBMN, 2022.
C. Suivi post-thérapeutique

La ré-élévation de la concentration sérique du taux de PSA après traitement peut être due à une récidive métastatique et/ou locale. La différence entre les deux repose sur le temps de doublement du PSA :
- s’il est lent, une récidive locale est suspectée : une IRM pourra être indiquée à la recherche d’une cible à biopsier (dans la loge, dans la prostate traitée ou au niveau des aires lymphatiques pelviennes) ;
- s’il est court, une extension métastatique est suspectée : une scintigraphie osseuse, ou une TEP au 18FNa (fluorure de sodium) si la technique est disponible, recherchera des métastases osseuses ; le scanner recherchera des métastases lymphatiques ;
- la TEP-TDM à la 18FCH sera recommandée pour l’exploration des récidives biologiques, plus particulièrement si le taux de PSA ≥ 2 ng/ml et/ou un temps de doublement du PSA ≤ 6 mois (figure 30.5) ;
- la TEP aux analogues de l’antigène membranaire spécifique de la prostate (PSMA) est indiquée chez les patients présentant une récidive biologique lorsque la TEP à la 18FCH est négative (figure 30.6).
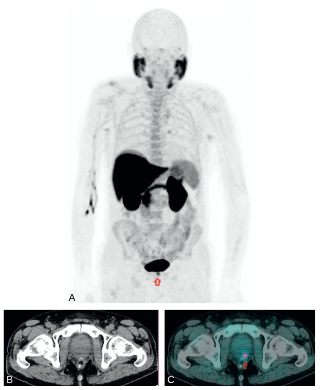

Fig. 30.5 TEP-TDM à la F-Choline : bilan d’extension d’une récidive biologique (taux de PSA à 7 ng/ml) d’un adénocarcinome prostatique initialement classé Gleason 4 + 4 et traité par radiothérapie externe.
Images mettant en évidence un hypermétabolisme suspect isolé prostatique gauche (MIP 3D (A), coupe axiale TDM (B) et TEP-TDM (C, flèche rouge), dont les biopsies ciblées ont confirmé une récidive.
Source : CERF, CNEBMN, 2022.
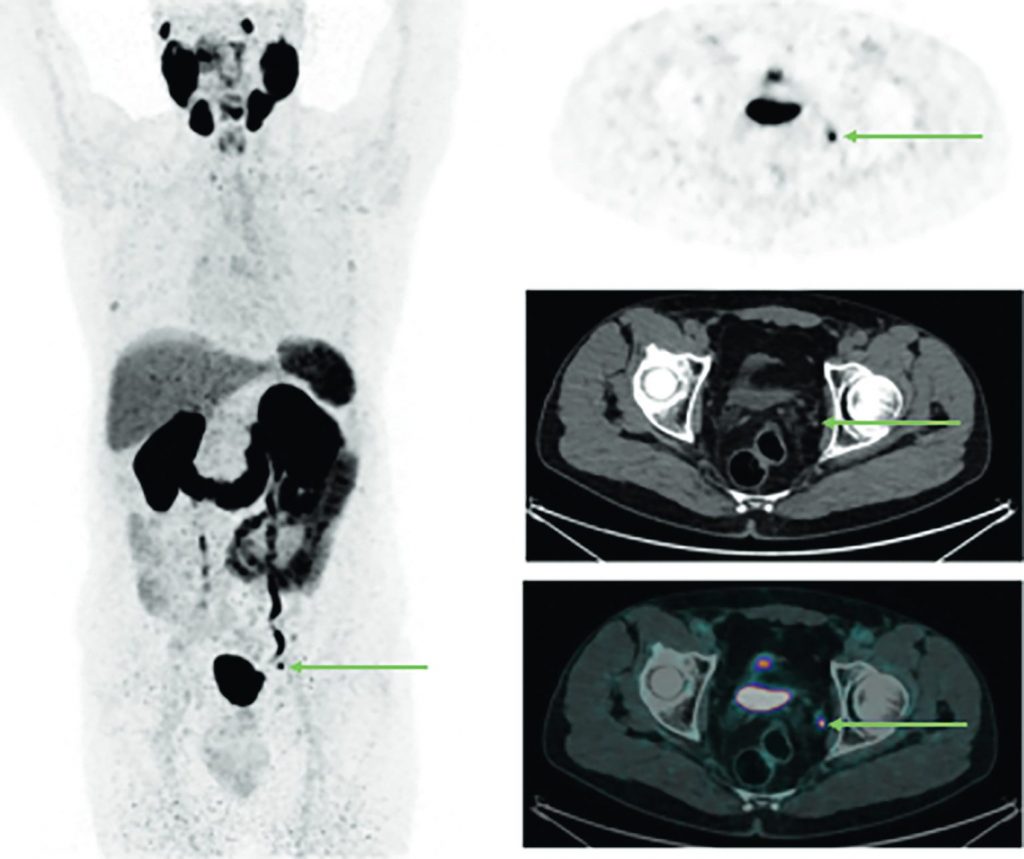

Fig. 30.6 TEP-TDM au 68Ga-PSMA. MIP 3D et coupe axiales TEP, TDM et TEP-TDM centrées sur le pelvis.
Patient présentant une récidive biologique dans un contexte d’adénocarcinome prostatique traité par prostatectomie deux ans auparavant. Images mettant en évidence une hyperfixation pathologique d’un ganglion obturateur gauche, suspecte de récidive isolée.
Source : CERF, CNEBMN, 2022.
Points clés
- Le dépistage individuel repose sur le toucher rectal et le dosage du PSA (Prostate Specific Antigen).
- L’échographie endorectale de la prostate permet uniquement de mesurer le volume prostatique et de guider les biopsies randomisées.
- L’IRM de prostate est recommandée avant la réalisation de toute biopsie en cas de suspicion clinique de cancer de prostate.
- L’IRM prostatique permet la détection et le bilan d’extension des cancers de prostate.
- Le compte rendu de l’IRM prostatique est standardisé avec l’attribution d’un score PI-RADS.
- La scintigraphie osseuse et le scanner thoraco-abdomino-pelvien sont indiqués dans le bilan d’extension des cancers à haut risque et intermédiaire haut (≥ ISUP 3).
- La TEP à la fluorocholine (18FCH) et la TEP au PSMA peuvent être indiquées dans l’évaluation des récidives après prostatectomie ou radiothérapie.