Plan de chapitre
ITEM 306 – Tumeurs de l’ovaire
I. Généralités
II. Stratégie d’exploration en imagerie
III. Sémiologie
Situations de départ
- 8 Masse abdominale.
- 17 Amaigrissement.
- 21 Asthénie.
- 99 Douleur pelvienne.
- 106 Masse pelvienne.
- 224 Découverte d’une anomalie abdominale à l’examen d’imagerie médicale.
- 229 Découverte d’une anomalie pelvienne à l’examen d’imagerie médicale.
Item, hiérarchisation des connaissances
ITEM 306 – Tumeurs de l’ovaire
| Rang | Rubrique | Intitulé | Descriptif |
| Définition | Principaux types de tumeurs primitives bénignes et malignes de l’ovaire* | Tumeurs fonctionnelles, tumeurs organiques bénignes (adénomes, cystadénomes), cancers (adénocarcinomes) | |
| Définition | Connaître les principaux types histologiques des tumeurs bénignes et malignes* | Adénocarcinomes (principaux types : séreux, mucineux) et variétés kystiques (cystadénocarcinomes), tumeurs à la limite de la malignité, métastases | |
| Prévalence, épidémiologie | Épidémiologie et pronostic des tumeurs bénignes et malignes* | Connaître les particularités épidémiologiques et pronostiques du cancer de l’ovaire | |
| Éléments physiopathologiques | Physiopathologie des cancers de l’ovaire* | Théorie de la cicatrisation Connaître l’existence de formes génétiques | |
| Diagnostic positif | Connaître les principaux facteurs de risque/protecteurs associés au cancer de l’ovaire* | Énumérer les principaux facteurs de risque/protecteurs associés au cancer de l’ovaire (notamment impact THM, contraception, parité, infertilité, ligature tubaire, salpingectomie) y compris les facteurs de risque familiaux | |
| Diagnostic | Connaître les indications de la cœlioscopie* | Stratégie d’utilisation de la cœlioscopie dans le bilan diagnostique et initial d’une masse ovarienne suspecte | |
| Examens complémentaires | Connaître les indications de l’imagerie d’une tumeur de l’ovaire | Échographie : détecte et caractérise une majorité de tumeurs ovariennes ; IRM complémentaire si masses annexielles indéterminées ou complexes ; TDM pour le diagnostic d’une carcinose/ascite ou en cas de tératome ; indications limitées de la TEP-TDM au 18FDG | |
| Examens complémentaires | Connaître l’intérêt diagnostique et pronostique de l’anatomopathologie* | Savoir que le diagnostic de certitude du cancer de l’ovaire nécessite une preuve histologique ; connaître les modalités d’obtention de la preuve histologique | |
| Examens complémentaires | Connaître les principaux marqueurs sériques et leur bon usage dans les tumeurs de l’ovaire* | Connaître le bon usage des marqueurs biologiques informatifs dans certaines formes de cancers (marqueurs CA125, CA19-9, HE4, AFP, hCG) et leur place dans le diagnostic devant une masse annexielle suspecte Savoir ne pas prescrire de dosage de CA125 en l’absence de tumeur ovarienne |
I. Généralités

Les tumeurs de l’ovaire sont des tumeurs très fréquentes qui présentent une grande variété de sous-types histologiques.
Leur diagnostic nécessite d’éliminer en premier lieu des lésions pseudotumorales, en particulier de nature fonctionnelle, endométriosiques ou infectieuses.

Tumeurs ovariennes primitives sont sous-tendues par la constitution histologique de l’ovaire qui présente trois éléments essentiels : l’épithélium de surface, les cellules germinales et le tissu de soutien conjonctif (cordons sexuels et stroma) :
- les tumeurs épithéliales sont les plus fréquentes (70 %), à prédominance kystique, et ont des végétations éventuelles spécifiques ;
- les tumeurs germinales (20 %) sont fréquentes chez les femmes jeunes et présentent une morphologie complexe, contenant des calcifications, des phanères et, majoritairement, de la graisse pathognomonique de tératomes ovariens ;
- les tumeurs des cordons sexuels et du stroma sont rares (8 %), majoritairement solides et parfois sécrétantes.
Les métastases ovariennes sont très rares (2 %), habituellement bilatérales et essentiellement solides, issues de cancers digestifs ou mammaires.
II. Stratégie d’exploration en imagerie
L’échographie-doppler est l’examen de première intention, pratiqué par voie sus-pubienne et, surtout, endovaginale, qui permet de détecter et de caractériser une majorité de tumeurs ovariennes. Ses limites sont liées aux caractéristiques des tumeurs : en particulier la taille (difficile à étudier si supérieure à 7 cm), la complexité tissulaire ou le caractère indéterminé quant à sa nature.
L’IRM est l’examen de référence pour la caractérisation des masses annexielles indéterminées ou complexes.
Le scanner ne présente plus aucune indication pour caractériser une tumeur ovarienne indéterminée en dehors des tératomes ovariens — il retrouve alors de la graisse ou des calcifications. En revanche, le scanner (thoraco)-abdomino-pelvien est la technique de référence pour le bilan initial d’extension d’un cancer ovarien et pour son suivi post-thérapeutique (figure 23.1).
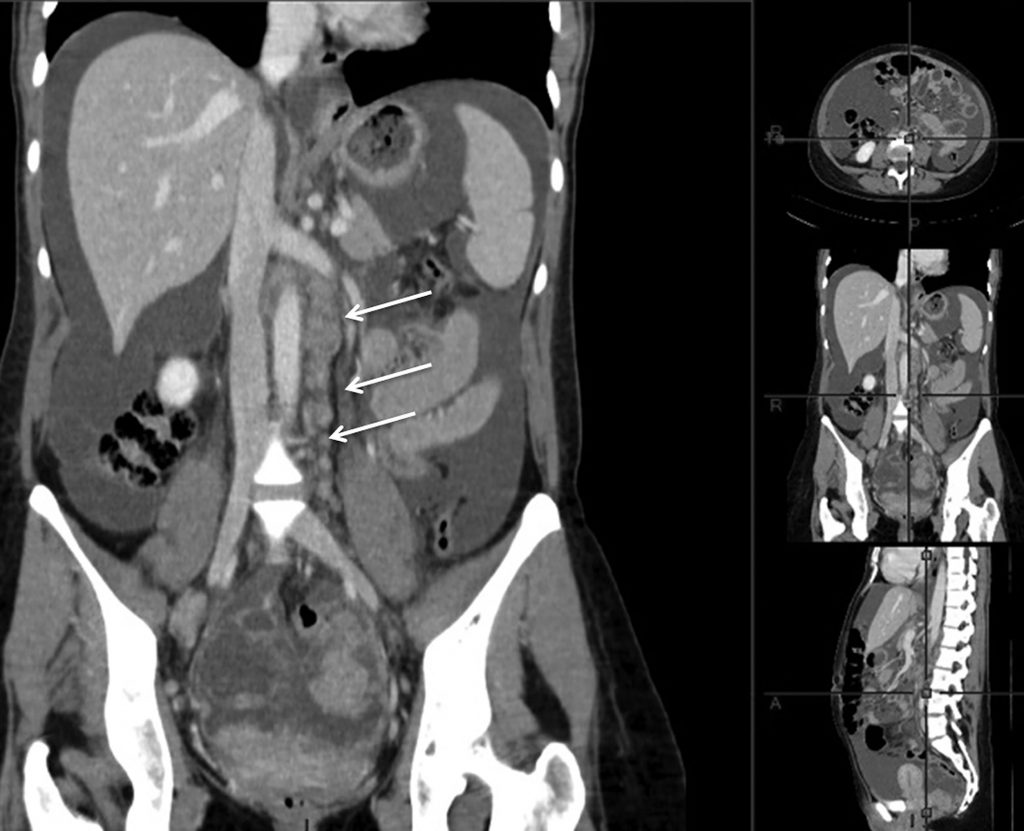
Fig. 23.1 Cystadénocarcinome ovarien.
Scanner abdominopelvien en reconstruction coronale retrouvant une extension lymphatique lombo-aortique (flèches) et une ascite.
Source : CERF, CNEBMN, 2022.
Une TEP-TDM 18FDG peut être réalisée dans le bilan d’extension initial en cas de cancer avancé (stade ≥ FIGO III).

Elle est de même indiquée pour la détection de la récidive du cancer de l’ovaire :
- en cas d’augmentation de la concentration sérique du CA125 (figure 23.2) ;
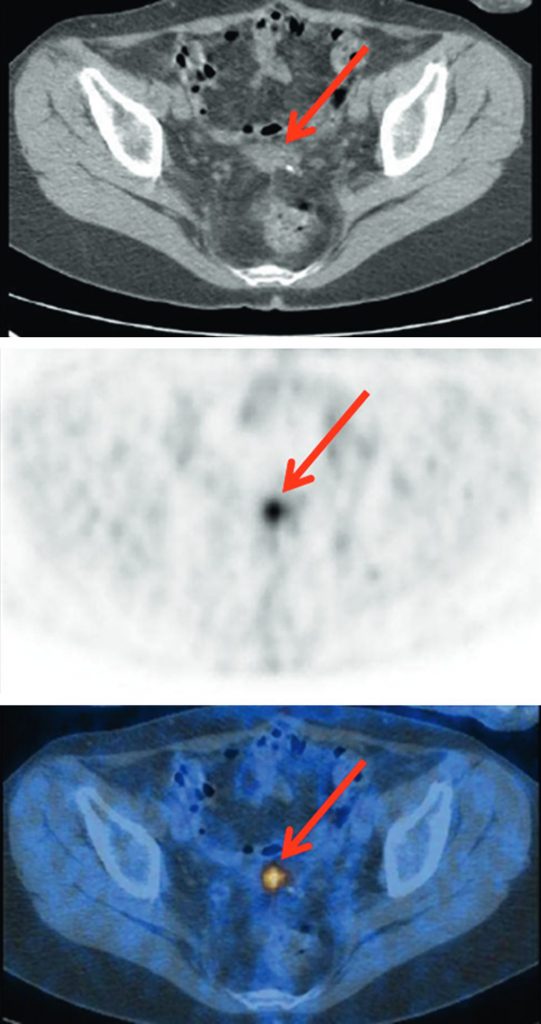

Fig. 23.2 Cancer de l’ovaire.
Lors du suivi, augmentation du CA125 à 56 UI/ml avec un bilan morphologique négatif. Découverte sur la TEP-TDM au 18FDG d’un nodule pelvien (flèche rouge) correspondant à une localisation péritonéale secondaire à l’analyse anatomopathologique.
Source : CERF, CNEBMN, 2022.
- en cas d’imagerie morphologique douteuse ;
- en cas de récidive a priori opérable au terme du bilan par l’imagerie morphologique (figure 23.3).
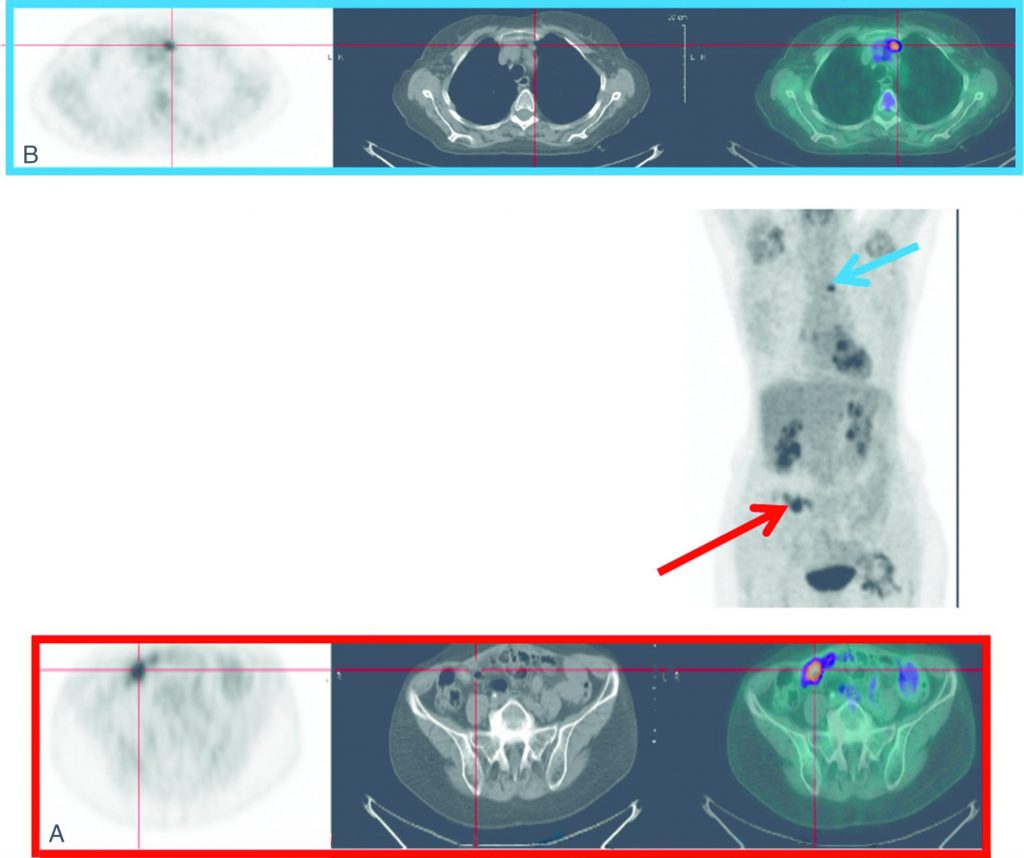

Fig. 23.3 TEP-TDM au 18FDG pour le bilan préchirurgical d’une suspicion de récidive d’un cancer de l’ovaire.
Visualisation de la récidive pelvienne correspondant à un nodule de carcinose péritonéale (A). Découverte d’une atteinte lymphatique médiastinale (B).
Source : CERF, CNEBMN, 2022.
III. Sémiologie

L’échographie-doppler doit rechercher :
- des critères en faveur de la malignité : parois épaisses, contours irréguliers, contenu tissulaire hétérogène, végétations vascularisées, cloisons épaisses et irrégulières (figure 23.4) ;
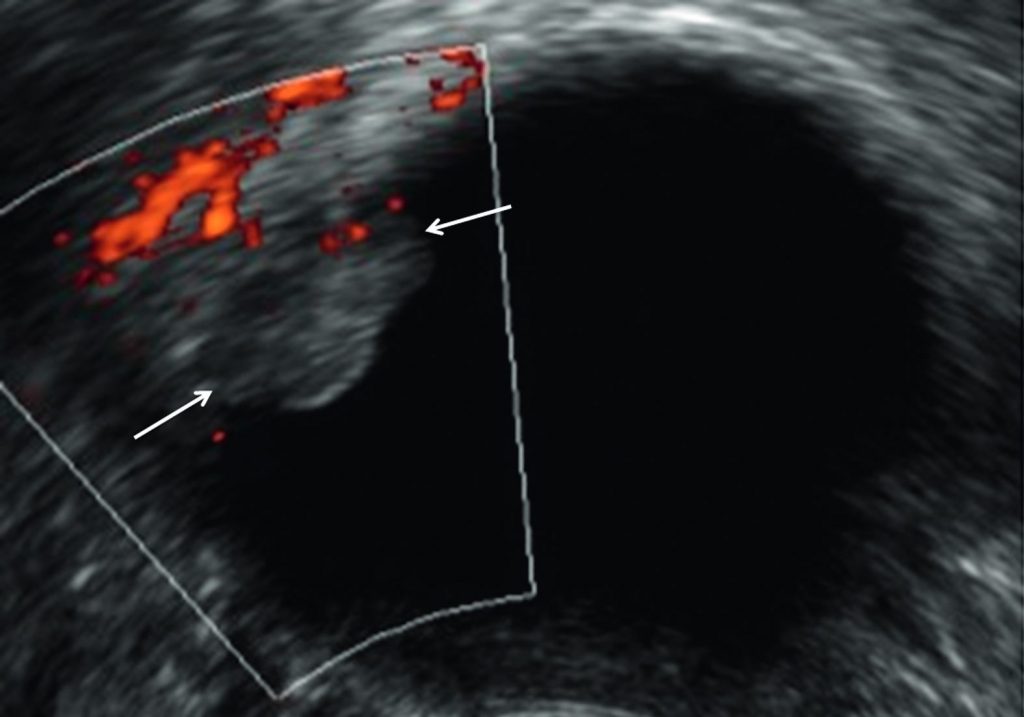

Fig. 23.4 Cystadénome séreux bénin.
Échographie endovaginale en coupe transversale retrouvant un kyste uniloculaire anéchogène contenant une végétation avasculaire en doppler énergie (flèches).
Source : CERF, CNEBMN, 2022.
- des signes d’extension, en priorité des nodules de carcinoses péritonéales.
En IRM, le tissu tumoral suspect de malignité présente typiquement (figure 23.5) :
- un signal intermédiaire en T2 ;
- un hypersignal en diffusion ;
- un rehaussement plus précoce que le myomètre sain adjacent après injection.
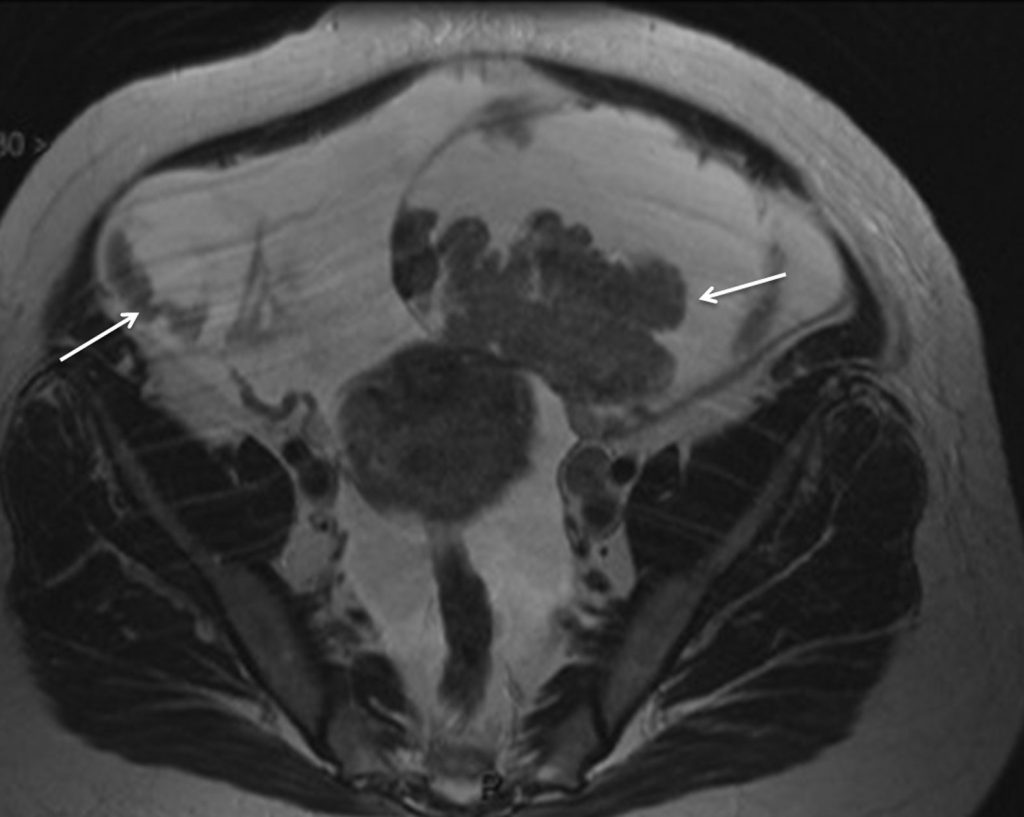

Fig. 23.5 Cystadénocarcinomes ovariens.
Coupe IRM en incidence axiale pondérée en T2 retrouvant une tumeur ovarienne bilatérale mixte avec une composante solide en signal intermédiaire en T2 et une volumineuse ascite.
Source : CERF, CNEBMN, 2022.
Cette dernière séquence avec injection permet d’apprécier le degré de perfusion tumorale au sein des anomalies retenues comme critères macroscopiques de suspicion de malignité que sont les cloisons épaisses irrégulières, les végétations et les portions tissulaires.
En TEP-TDM, le tissu tumoral apparaît comme des hyperfixations correspondant à une accumulation pathologique de 18FDG.
Points clés
- Les tumeurs de l’ovaire sont très fréquentes.
- Il est nécessaire d’éliminer en premier lieu des lésions pseudotumorales.
L’échographie-
- doppler est l’examen de première intention, qui permet de détecter et de caractériser une majorité de tumeurs ovariennes.
- L’IRM est l’examen de référence pour la caractérisation des masses annexielles indéterminées ou complexes.
- Le scanner n’a pas d’intérêt diagnostique en dehors des tératomes ovariens mais est la technique de référence pour le bilan initial d’extension d’un cancer ovarien et pour son suivi post-thérapeutique.
- La TEP-TDM au 18FDG peut être proposée dans le bilan d’extension du cancer de l’ovaire stade ≥ FIGO III.