Plan de chapitre
ITEM 276 – Hépatomégalie et masse abdominale
ITEM 304 – Tumeurs du foie, primitives et secondaires
I. Généralités
II. Stratégie d’exploration en imagerie devant une tumeur du foie
III. Carcinome hépatocellulaire
– A. Stratégie d’exploration du carcinome hépatocellulaire
– B. Sémiologie du carcinome hépatocellulaire
IV. Métastases hépatiques
– A. Stratégie d’exploration en imagerie pour les métastases hépatiques
– B. Sémiologie des métastases hépatiques
V. Hémangiome
– A. Stratégie d’exploration en imagerie pour l’hémangiome hépatique
– B. Sémiologie typique des hémangiomes hépatiques
VI. Kyste hépatique simple (ou kyste biliaire)
Situations de départ
- 3 Distension abdominale.
- 6 Hépatomégalie.
- 4 Douleur abdominale.
- 17 Amaigrissement.
- 21 Asthénie.
- 47 Ictère.
- 198 Cholestase.
- 206 Élévation des transaminases sans cholestase.
Items, hiérarchisation des connaissances
ITEM 276 – Hépatomégalie et masse abdominale
| Rang | Rubrique | Intitulé | Descriptif |
| Définition | Connaître la définition d’une masse abdominale* | ||
| Étiologie | Connaître les principales causes d’hépatomégalie et de masse abdominale* | Y compris parasitaires (échinococcoses, schistosomoses, leishmaniose viscérale) | |
| Diagnostic positif | Connaître la démarche diagnostique devant une hépatomégalie et une masse abdominale* | Orienter la démarche selon le caractère diffus/sectoriel ou homogène/hétérogène de l’HMG, reconnaître une maladie chronique du foie et une tumeur hépatique (bénigne ou maligne) | |
| Diagnostic positif | Connaître les éléments de l’interrogatoire et l’examen physique aidant au diagnostic d’hépatomégalie et de masse abdominale* | ||
| Examens complémentaires | Connaître les différents examens biologiques et radiologiques à réaliser en première intention devant une masse abdominale en fonction de l’étiologie suspectée | Connaître les causes de masse abdominale selon la localisation, la clinique et les caractéristiques de la masse | |
| Examens complémentaires | Connaître les indications et contre-indications de la ponction et de la biopsie de foie* | Biopsie hépatique transpariétale et transjugulaire, méthodes de guidage de la biopsie, Fibroscan, attention au kyste hydatique | |
| Contenu multimédia | Exemple de TDM de CHC typique chez un patient porteur d’une cirrhose | ||
| Contenu multimédia | Exemple de TDM de métastases hépatiques | ||
| Contenu multimédia | Exemple d’image TDM de kyste hépatique typique | ||
ITEM 304 – Tumeurs du foie, primitives et secondaires
| Rang | Rubrique | Intitulé | Descriptif |
| Définition | Connaître les principaux types histologiques des tumeurs bénignes et malignes* | hémangiome, hyperplasie nodulaire focale, adénome hépatocytaire, carcinome hépato-cellulaire, cholangiocarcinome, métastases | |
| Prévalence, épidémiologie | Connaître la prévalence et l’épidémiologie des différentes tumeurs bénignes et malignes du foie* | Carcinome hépatocellulaire | |
| Étiologie | Connaître la liste des principales hépatopathies augmentant le risque de survenue ultérieure d’un cancer primitif du foie | cirrhose, stéato-hépatite | |
| Diagnostic positif | Démarche diagnostique initiale | circonstances de découverte, imagerie, biopsie d’une image hépatique | |
| Examens complémentaires | Connaître la stratégie d’exploration en imagerie devant une tumeur du foie | ||
| Diagnostic positif | Démarche diagnostique positive d’une métastase hépatique | Connaître les caractéristiques cliniques et radiologiques principales d’une métastase hépatique | |
| Diagnostic positif | Connaître la présentation clinique d’une tumeur primitive du foie* | Énumérer les principaux facteurs prédisposants, histoire naturelle, symptomatologie et examen clinique du carcinome hépatocellulaire | |
| Contenu multimédia | Scanner typique de métastases hépatiques | ||
| Éléments physiopathologiques | Connaître la physiopathologie et les facteurs de risque des tumeurs biliaire* | Tumeurs des voies bilaires | |
| Diagnostic positif | Connaître la présentation clinique des tumeurs biliaires* | Tumeurs des voies bilaires | |
| Prise en charge | Connaître les principes de la prise en charge des principales tumeurs bénignes et malignes du foie* | Tumeurs des voies bilaires | |
I. Généralités

Les tumeurs secondaires du foie sont les métastases hépatiques. Toutes les tumeurs primitives peuvent métastaser au foie, mais les métastases hépatiques les plus fréquentes sont secondaires à un cancer du côlon ou du rectum, à un cancer bronchique, à un cancer du sein, du pancréas ou de l’estomac.
Les tumeurs primitives du foie sont constituées :
- de tumeurs malignes, qui ont principalement pour origine les hépatocytes (carcinome hépatocellulaire, ou CHC) ou les voies biliaires (cholangiocarcinome) ;
- de tumeurs bénignes, dont les plus fréquentes sont les tumeurs hépatocytaires (adénome, hyperplasie nodulaire et focale), les kystes hépatiques et les hémangiomes.
Les tumeurs bénignes du foie les plus fréquentes sont le kyste hépatique simple (parfois dénommé kyste biliaire) et l’hémangiome. Les métastases hépatiques sont les tumeurs malignes du foie les plus fréquentes lorsque le foie est sain. Le CHC est la tumeur maligne du foie la plus fréquente en cas de cirrhose.
Il est souvent facile de diagnostiquer un kyste hépatique et un hémangiome hépatique en imagerie.
Il faut savoir qu’il est très souvent possible de différencier les tumeurs secondaires et les tumeurs primitives hépatocytaires en imagerie.
Seule l’imagerie des hémangiomes, des kystes hépatiques et des métastases, du fait de leur fréquence, et celle du CHC, du fait de ses caractéristiques typiques, doivent être connues, de même que le raisonnement en imagerie devant une tumeur du foie.
II. Stratégie d’exploration en imagerie devant une tumeur du foie
L’exploration d’une tumeur en imagerie comporte deux phases qui peuvent être faites simultanément ou nécessiter des examens différents :
- la détection : celle-ci peut être faite dans le cadre d’un dépistage, par exemple lors du suivi semestriel d’une cirrhose (cf. chapitre 5) ou lors du suivi d’une tumeur, par exemple lors du bilan d’extension d’un cancer du côlon. La détection peut aussi être faite lors de l’exploration d’un symptôme (en rapport ou non avec la tumeur) ou par hasard (découverte fortuite) ;
- la caractérisation : il s’agit de définir la nature d’une tumeur connue (CHC, hémangiome, etc.).
Pour progresser dans le diagnostic étiologique d’une tumeur du foie, il faut tout d’abord rechercher des signes de cirrhose (cf. chapitre 5). Ensuite, il faut analyser l’aspect de la tumeur et sa cinétique de rehaussement après injection intraveineuse d’un agent de contraste en utilisant des produits de contraste disponibles en échographie, au scanner ou en IRM, et en réalisant des coupes du foie et de la tumeur à trois temps successifs :

- environ 30 à 35 secondes après l’injection de produit de contraste, au temps dit « artériel » : à cette phase, les tumeurs hépatocytaires primitives (bénignes ou malignes) se rehaussent intensément ;
- environ 70 à 80 secondes après l’injection, au temps dit « portal » : les métastases se rehaussent en général moins que le foie et deviennent mieux visibles en raison d’un contraste élevé avec le foie adjacent ;
- environ 3 à 5 minutes après l’injection, au temps dit « tardif » : les CHC se présentent de façon très spécifique et sont le siège d’un lavage (en anglais, wash-out) : la tumeur est moins rehaussée que le foie adjacent.
Le raisonnement est illustré par la figure 16.1.
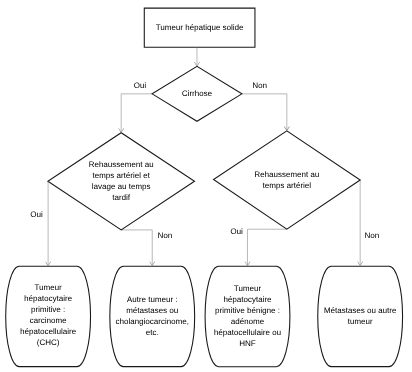
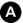
Fig. 16.1. Arbre décisionnel de l’imagerie devant une tumeur du foie.
Source : CERF, CNEBMN, 2022.
III. Carcinome hépatocellulaire
A. Stratégie d’exploration du carcinome hépatocellulaire
Le carcinome hépatocellulaire survient dans 90 % des cas sur un foie d’hépatopathie chronique (cf. chapitre 19). Une surveillance semestrielle par échographie (et scanner ou IRM en cas de limitation de l’échographie) de ces hépatopathies est recommandée. Ainsi, le CHC devrait idéalement être découvert le plus souvent lors de ce suivi. En pratique, le suivi est mal appliqué (moins de 30 % des patients cibles) ou l’hépatopathie chronique n’est pas connue, la découverte étant alors faite lors de l’exploration de symptômes qui amènent parfois à découvrir la tumeur et l’hépatopathie sous-jacente en même temps.
Lorsque le nodule est découvert, il doit être caractérisé pour affirmer qu’il s’agit bien d’un CHC, au mieux par IRM, par scanner à défaut.
B. Sémiologie du carcinome hépatocellulaire

En échographie, l’aspect de la lésion est variable, hypoéchogène, hyperéchogène ou mixte.
Au scanner, elle est spontanément légèrement hypodense par rapport au foie avec parfois des remaniements hémorragiques (hyper- ou isodenses par rapport au foie) (figure 16.2).
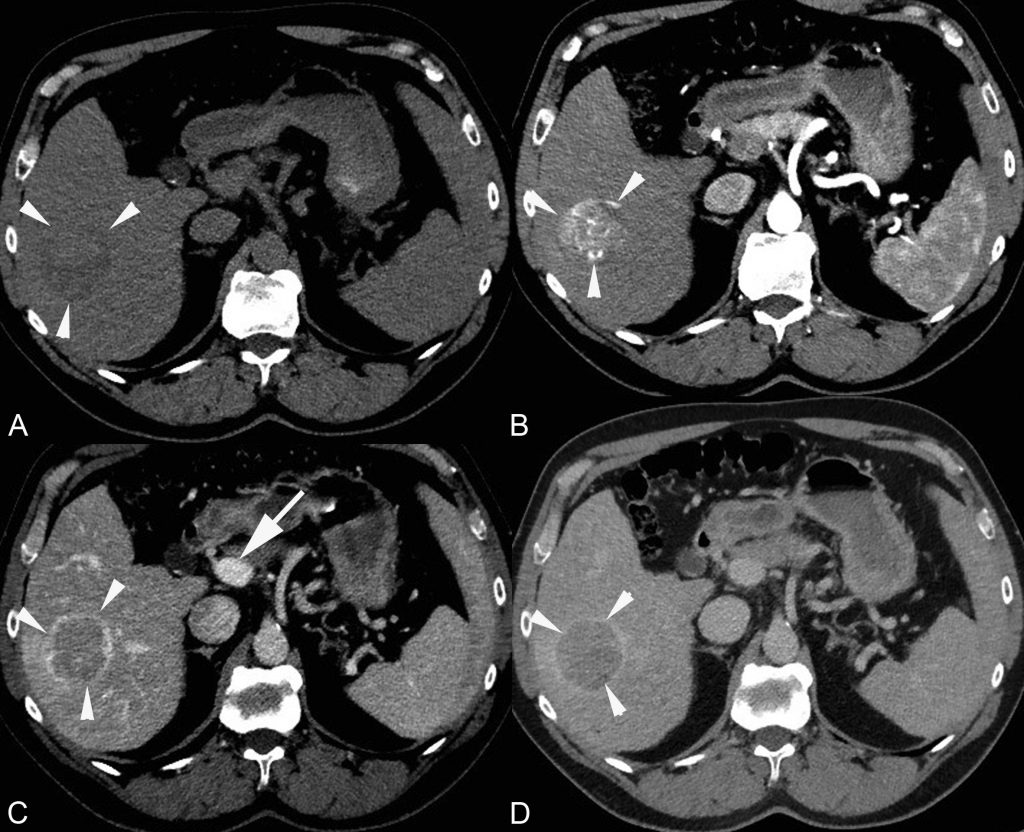

Fig. 16.2. Exemple d’examen scanner d’un CHC typique chez un patient atteint de cirrhose virale C.
(A) Coupe sans injection : tumeur (têtes de flèches) du foie droit avec aspect hétérogène, discrètement hypodense par rapport au foie adjacent. (B) Temps artériel : prise de contraste hétérogène de la lésion alors que le parenchyme hépatique ne se rehausse quasi pas. (C) Temps portal : rehaussement du foie par le flux porte (flèche). Le CHC est isodense au foie avec un rehaussement périphérique (capsule). (D) Temps tardif : rehaussement diffus du parenchyme hépatique et lavage de la lésion.
Source : CERF, CNEBMN, 2022.
En IRM, la lésion est typiquement hypo-intense en pondération T1 et hyperintense en pondération T2 (figure 16.3). Elle peut être bien ou mal limitée.
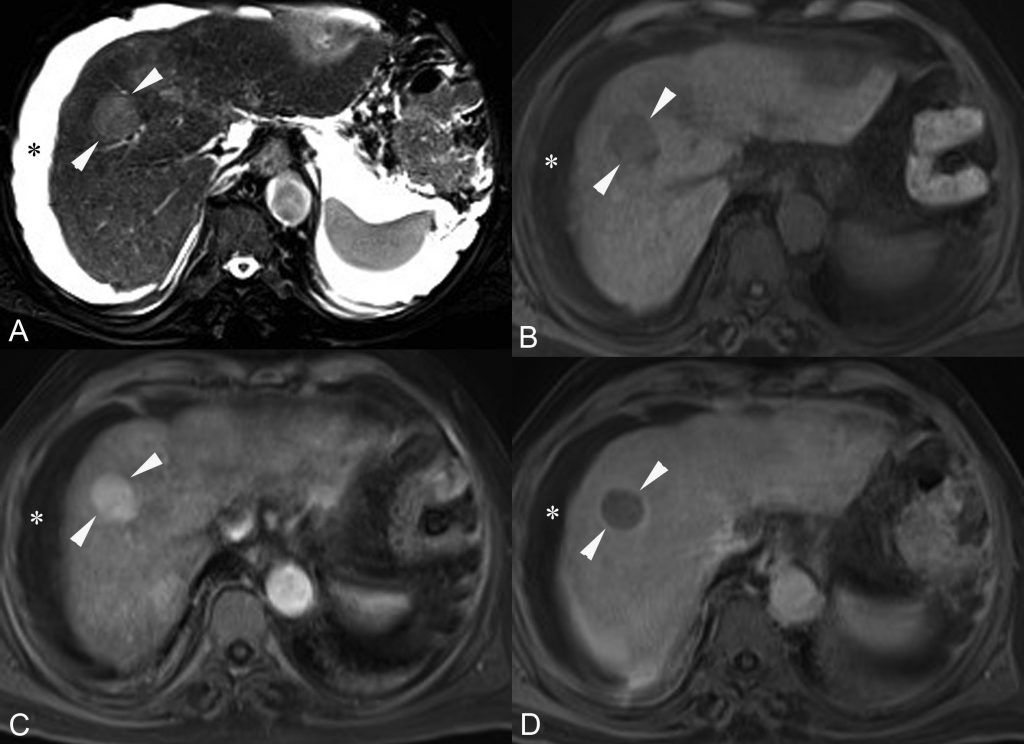

Fig. 16.3. IRM d’un CHC dans un foie de cirrhose (flèches).
Le foie présente des signes de cirrhose et est entouré d’une ascite abondante (∗) en hypersignal sur les séquences en pondération T2 (A) et en hyposignal sur les séquences en pondération T1 (B, C, D). En pondération T2 (A), le CHC apparaît en discret hypersignal. En pondération T1 avant injection (B), il apparaît en hyposignal homogène. Après injection : au temps artériel (C), la lésion présente un rehaussement homogène, suivi d’un lavage très net au temps tardif (D). Le temps portal n’est pas figuré ici.
Source : CERF, CNEBMN, 2022.
Après injection de produit de contraste au scanner ou en IRM, le CHC est caractérisé par un rehaussement important au temps artériel suivi d’un lavage au temps veineux portal ou tardif (figures 16.2 et 16.3), c’est-à-dire que la lésion devient plus hypodense ou hypo-intense que le foie adjacent.
Cet aspect du CHC est si caractéristique que, rencontré dans un foie de cirrhose (et uniquement dans ce cas), la biopsie percutanée n’est pas nécessaire pour poser le diagnostic. Il s’agit alors du « diagnostic non invasif » du CHC. La biopsie n’est nécessaire qu’en cas de forme atypique ou lorsqu’il existe un fort doute avec des métastases hyper-rehaussées, d’où l’importance du contexte clinique.
Cette tumeur a tendance à envahir la lumière de la veine porte (ou plus rarement des veines hépatiques ou des voies biliaires), ce qui est également très évocateur (figure 16.4).

Fig. 16.4. Coupe scanner : au temps tardif après injection de produit de contraste d’un CHC développé dans le foie droit visible sous la forme d’une tumeur hypodense en raison du lavage (flèches creuses).
Mise en évidence d’une extension tumorale (flèche) dans la lumière de la veine porte (tête de flèche). Le temps artériel non montré ici objectivait un rehaussement ; le diagnostic de CHC avec envahissement tumoral de la veine porte est donc établi.
Source : CERF, CNEBMN, 2022.
IV. Métastases hépatiques
A. Stratégie d’exploration en imagerie pour les métastases hépatiques
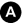
L’échographie peut découvrir les lésions, voire affirmer le diagnostic si le cancer primitif est connu et les lésions multiples.
Le scanner est toutefois l’examen de référence le plus employé en cancérologie car il permet lors du bilan d’extension d’une tumeur connue de voir les lésions hépatiques, d’orienter vers le diagnostic de métastases après injection de produit de contraste iodé mais aussi de détecter au cours du même examen d’autres métastases (pulmonaires, osseuses, péritonéales). Si les métastases sont découvertes alors que le cancer n’est pas connu, il peut aussi participer à la recherche du cancer primitif. Lors du suivi des métastases au cours du temps pendant un traitement, par exemple par une chimiothérapie, il permet d’effectuer des mesures précises des lésions pour suivre l’efficacité du traitement.
L’IRM permet de détecter plus de métastases que le scanner, surtout celles de petite taille. Ainsi, si les métastases sont uniquement localisées au foie et que l’on souhaite les réséquer toutes, l’IRM est le meilleur examen pour s’assurer du nombre exact des lésions, afin de ne pas risquer d’en oublier au moment de la chirurgie. L’IRM peut également être utilisée en cas de contre-indication de l’injection de produit de contraste iodé au scanner (insuffisance rénale ou allergie aux produits de contraste iodés). Il est aussi possible de réaliser une IRM pour caractériser des lésions douteuses ou lors du suivi.
La TEP-TDM au 18FDG est indiquée pour le bilan d’extension des lésions intrahépatiques suspectes de lésions secondaires, à la recherche d’une tumeur primitive, si les examens standards sont non contributifs (mammographie, FOGD et colonoscopie), ainsi que pour la détection des métastases extrahépatiques, en montrant une hyperfixation (figure 16.5).

Fig. 16.5. Images en coupes axiales de TDM (à gauche) et TEP au 18FDG fusionnées à la TDM (à droite) réalisées pour recherche d’une tumeur primitive dans un contexte de foie multimétastatique confirmant les multiples lésions hypermétaboliques hépatiques suspectes (A) et mettant en évidence un hypermétabolisme suspect d’un processus tissulaire au sein du cæcum (B, flèche). L’analyse anatomopathologique de cette lésion après exérèse est en faveur d’un adénocarcinome.
Source : CERF, CNEBMN, 2022.
B. Sémiologie des métastases hépatiques

Les métastases hépatiques sont généralement multiples mais ce n’est pas obligatoire.
En échographie, leur aspect est variable, hypoéchogène, hyperéchogène ou mixte. Au scanner, elles sont légèrement hypodenses par rapport au foie avant injection (figure 16.6). En IRM, les lésions sont typiquement hypo-intenses en pondération T1 et hyperintenses en pondération T2.
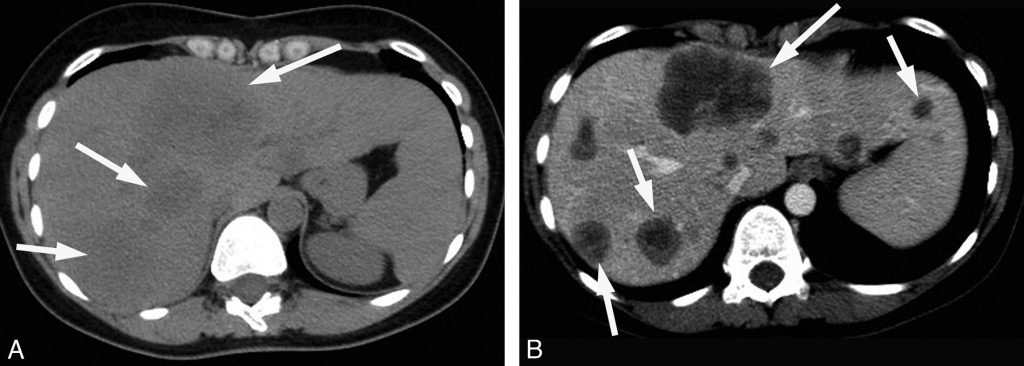

Fig. 16.6. Coupes scanner de métastases hépatiques d’origine colorectale.
La coupe sans injection montre plusieurs lésions spontanément hypodenses (flèches) (A). Au temps portal (B), le parenchyme hépatique se rehausse beaucoup plus que les lésions, ce qui augmente son contraste avec le parenchyme hépatique adjacent.
Source : CERF, CNEBMN, 2022.
Après injection de produit de contraste au scanner ou en IRM, elles sont caractérisées par un rehaussement faible et hétérogène (plutôt en couronne périphérique) au temps artériel ou portal, ce qui les rend bien visibles sous forme de nodule(s) hypodense(s) par rapport au foie.
V. Hémangiome
Il s’agit d’une lésion vasculaire bénigne de l’adulte constituée de cavités sanguines qui ont une forme et une taille variables, du millimètre au centimètre. Elle peut être unique ou multiple. Elle est généralement asymptomatique. Dans l’immense majorité des cas, l’hémangiome hépatique est découvert de façon fortuite à l’occasion d’une échographie, d’un scanner ou d’une IRM abdominale.
A. Stratégie d’exploration en imagerie pour l’hémangiome hépatique
Lorsque l’hémangiome est découvert en échographie de manière fortuite sur un foie sain et qu’il présente un aspect caractéristique, il n’est pas nécessaire de faire d’autres examens. Si l’aspect échographique n’est pas formel — il existe des hémangiomes atypiques en échographie —, si la lésion est développée sur un foie d’hépatopathie chronique ou de cirrhose, ou lors du bilan d’extension d’un cancer, c’est l’IRM qui est l’examen de référence à demander.
B. Sémiologie typique des hémangiomes hépatiques

En échographie, l’hémangiome est une lésion hyperéchogène, homogène, avec un contour bien limité et un renforcement postérieur (figure 16.7). Il n’existe pas de signal doppler en son sein.
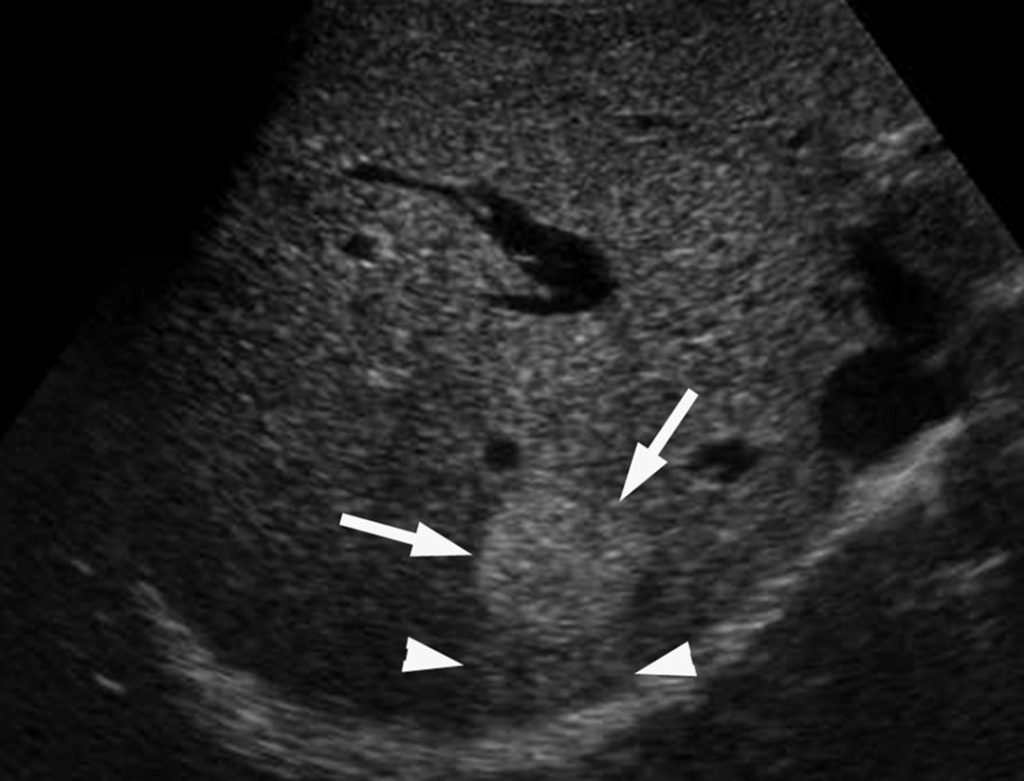

Fig. 16.7. Image échographique d’un hémangiome typique (flèches). Formation arrondie hyperéchogène homogène avec discret renforcement postérieur du faisceau ultrasonore (têtes de flèches).
Source : CERF, CNEBMN, 2022.
Au scanner, la lésion est bien limitée et très hypodense avant injection. L’IRM montre une lésion généralement homogène, bien limitée, très hypo-intense sur les séquences en pondération T1 et qui a la particularité d’être très hyperintense sur les séquences en pondération T2 (figure 16.8).
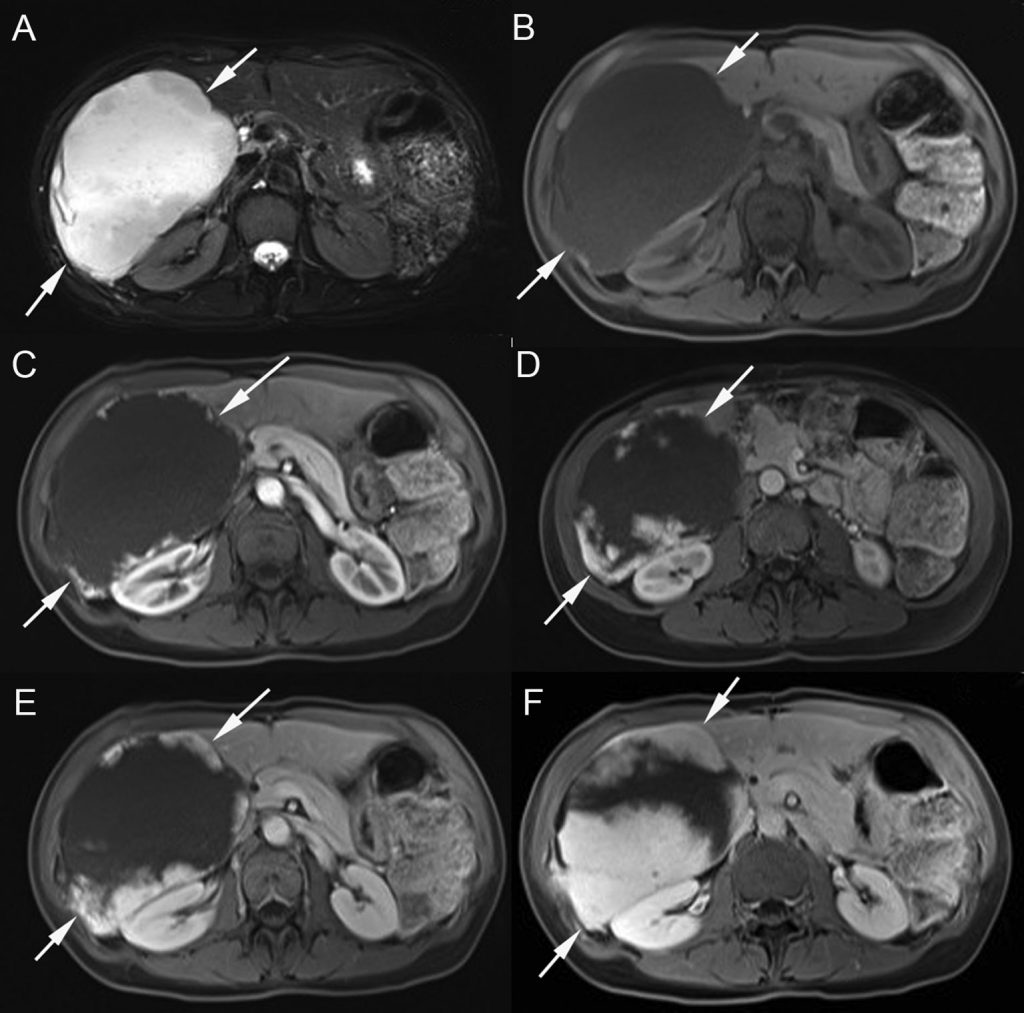

Fig. 16.8. IRM d’un hémangiome du foie droit. En pondération T2, il apparaît en franc hypersignal, d’intensité proche de celle du liquide cérébrospinal (A). En pondération T1, il présente un hyposignal homogène avant injection de chélates de gadolinium (B). Après injection, sur les temps artériel (C), portal (D), tardif (E) et très tardif (F), des prises de contraste périphériques sont initialement discontinues, puis confluent progressivement les unes avec les autres pour réaliser un rehaussement complet de la périphérie vers le centre (centripète).
Source : CERF, CNEBMN, 2022.
Après injection de produit de contraste en échographie, au scanner ou en IRM, on observe un rehaussement caractéristique périphérique discontinu au temps artériel suivi d’une confluence des zones de rehaussement de la périphérie vers le centre au cours des minutes qui suivent l’injection (correspondant au remplissage progressif de proche en proche par le produit de contraste des lacs vasculaires) avec une persistance du rehaussement sur les temps tardifs (figures 16.7 et 16.8).
VI. Kyste hépatique simple (ou kyste biliaire)
Il s’agit de formations liquidiennes séreuses entourées d’un épithélium unicellulaire ne communiquant pas avec les voies biliaires. Elles peuvent être uniques ou multiples. Leur fréquence augmente avec l’âge.
Ces kystes présentent toutes les caractéristiques des kystes simples :
- anéchogène avec un renforcement postérieur en échographie sans paroi ni cloison (figure 16.9) ;
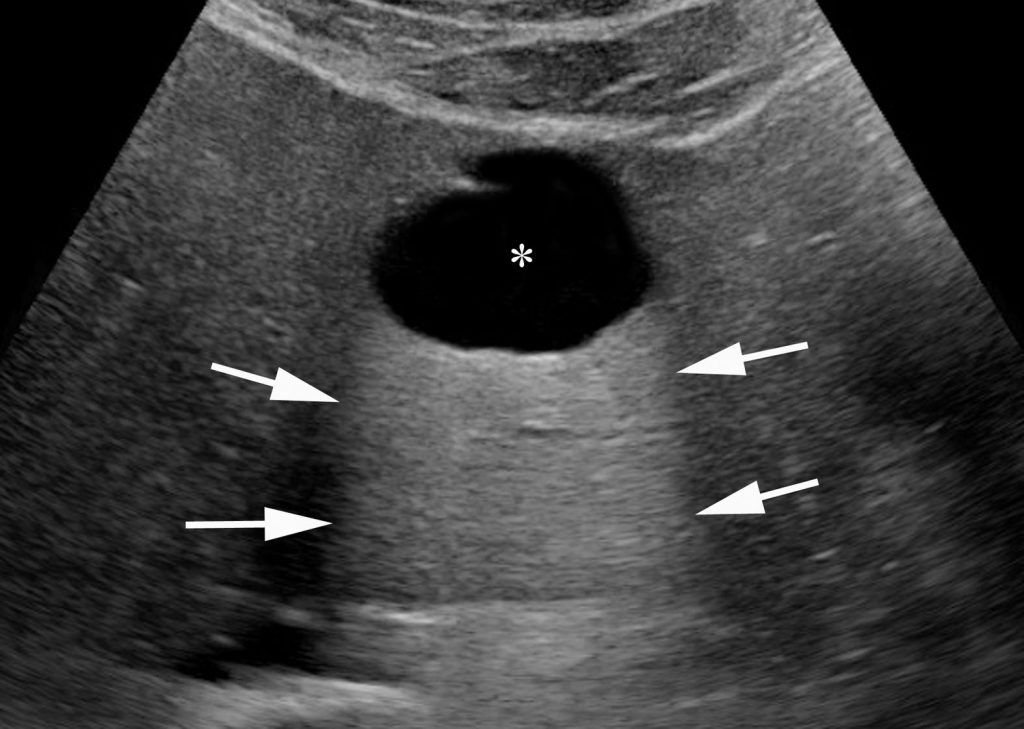

Fig. 16.9. Image échographique de kyste hépatique typique réalisant un aspect strictement anéchogène (∗) avec renforcement postérieur (flèches) au sein du parenchyme hépatique.
Source : CERF, CNEBMN, 2022.
- de densité liquidienne en scanner ne se rehaussant pas après injection (figure 16.10) ;
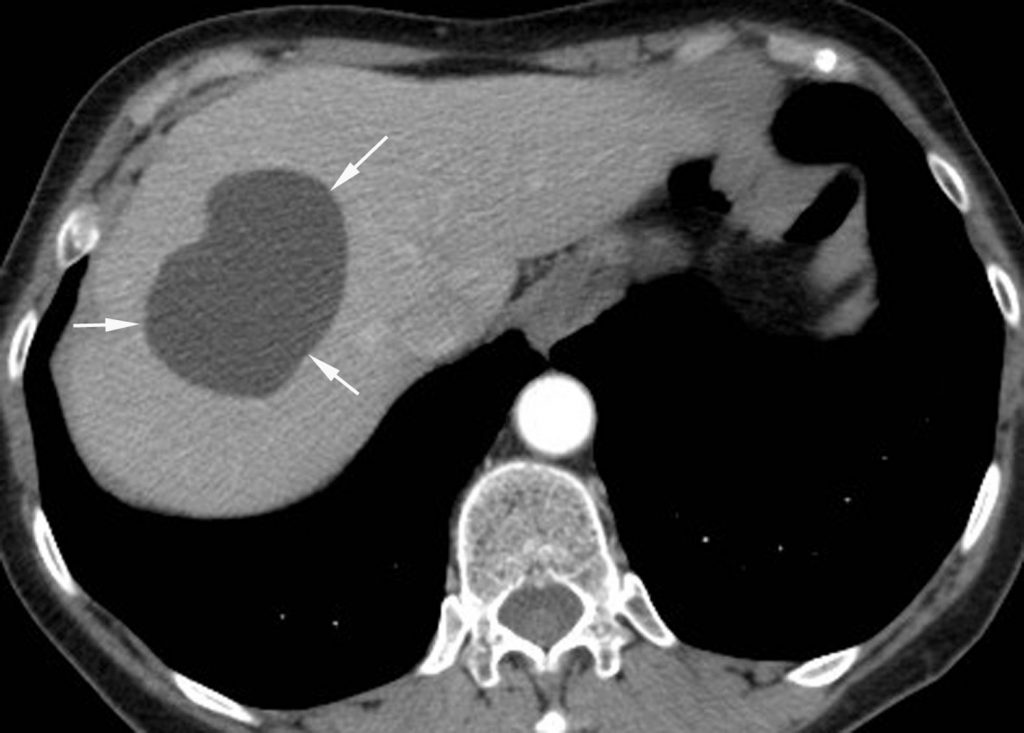

Fig. 16.10. Coupe scanner après injection de produit de contraste iodé d’un kyste hépatique simple (flèches). Le kyste se présente comme une formation hypodense de densité liquidienne (11 UH sur cet exemple). Il n’y a pas de paroi, de cloison ou de végétation.
Source : CERF, CNEBMN, 2022.
- en franc hypersignal en pondération T2 et sans prise de contraste après injection (figure 16.11).
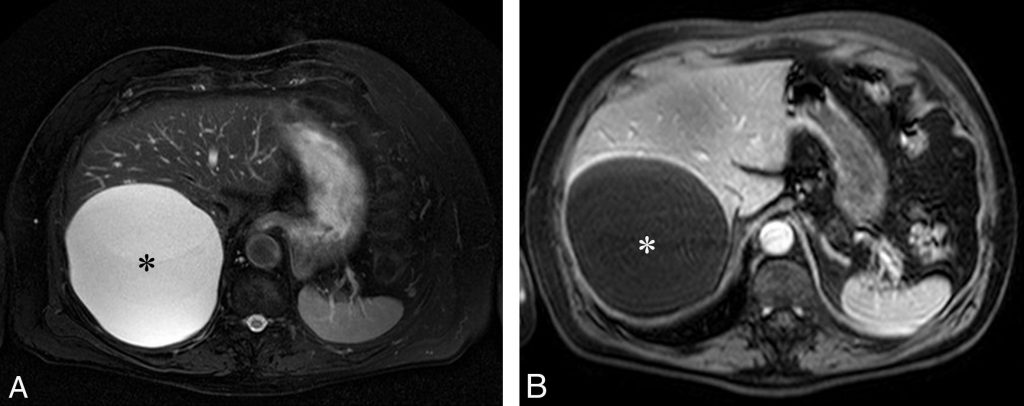

Fig. 16.11. IRM d’un kyste hépatique typique du foie droit. Il apparaît hyperintense en pondération T2 (A), comparable au liquide cérébrospinal. Sur une séquence en pondération T2 seule, la différence avec un hémangiome est difficile. À la différence de ce dernier, en pondération T1 après injection (B), le kyste présente un hyposignal franc et ne se rehausse pas.
Source : CERF, CNEBMN, 2022.
La découverte d’un kyste simple d’aspect typique ne nécessite pas d’autre examen d’imagerie.
Points clés
- Le kyste et l’hémangiome sont les tumeurs hépatiques bénignes les plus fréquentes. Ils sont très caractéristiques en imagerie et leur diagnostic radiologique est généralement aisé.
- Le carcinome hépatocellulaire est la tumeur hépatique maligne primitive la plus fréquente. Elle survient surtout en cas de cirrhose. Il présente une cinétique de rehaussement typique, se traduisant par un rehaussement intense à la phase artérielle et par un lavage au temps portal et/ou tardif dont l’association permet, en cas de cirrhose, d’en affirmer le diagnostic.
- Les métastases hépatiques constituent les lésions malignes les plus fréquentes du foie non cirrhotique. Leur aspect est évocateur en imagerie mais il faut le plus souvent une ponction-biopsie pour les caractériser si le primitif n’est pas connu.
- L’IRM est l’examen de référence pour caractériser les tumeurs hépatiques.
- En cas de découverte échographique d’une lésion non caractérisée, il faut demander une IRM en première intention pour caractérisation lésionnelle. Le scanner n’est utilisé que dans les cas où l’on s’oriente vers une tumeur maligne et que l’IRM n’est pas disponible.
- La TEP-TDM au 18FDG est indiquée pour le bilan d’extension des lésions intrahépatiques suspectes de lésions secondaires, notamment pour la recherche d’une tumeur primitive, si les examens standards sont non contributifs (mammographie, FOGD et colonoscopie).